Neurologické hypotézy u panické poruchy
Neurobiological Hypotheses in Panic Disorder
Panic disorder is a mental disorder characterized by recurrent panic attacks accompanied by significant somatic and psychological symptoms. Ethiopathogenesis of panic disorder remains unclear although clinical manifestation and proven algorithms of treatment are known. Due to paroxysmal nature of the disorder and its symptoms, functional imaging techniques provide ambiguous results. Leading neurotransmitter theories are based on the proven efficacy of antidepressants treatment. This includes the role of the neurotransmitters involved in modulation of fear circuit (serotonin, norepinephrine, gamma-aminobutyric acid, glutamate, cortikoliberin etc.). From neuroanatomical point of view, the nucleus of amygdala, with a large number of pathways involved in the panic reaction, plays the key role in triggering panic attacks. In contrast, prolonged anxiety is associated with activation of bed nucleus striae terminalis. The entire process is complex and involves interaction of the brainstem and cortical centres, the role of which consists of affective modulation of the limbic system and its regulation by volitional processes.
Key words:
panic disorder – magnetic resonance imaging – positron emission tomography –serotonin – norepinephrine – amygdala –locus coeruleus – prefrontal lobes
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
P. Šilhán 1; MUDr. Martin Hýža 1; D. Kamarádová 2; K. Látalová 2; J. Praško 2
Působiště autorů:
Oddělení psychiatrické, FN Ostrava
1; Klinika psychiatrie LF UP a FN Olomouc
2
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(3): 314-319
Kategorie:
Přehledný referát
Souhrn
Panická porucha je psychická porucha charakterizovaná rekurentními panickými atakami, které jsou doprovázeny výraznými somatickými a psychickými symptomy. Navzdory definovanému klinickému obrazu a ověřeným algoritmům léčby zůstává etiopatogeneze panické poruchy nejasná. Vzhledem k záchvatovému charakteru poruchy a symptomové rozmanitosti přinášejí funkční zobrazovací metody nejednoznačné výsledky. Nejlépe rozpracované jsou neurotransmiterové teorie opírající se o prokazatelnou úspěšnost antidepresiv. Tyto zahrnují roli řady neurotrasmiterů podílejících se na modulaci okruhu strachu (serotonin, noradrenalin, gamaaminomáselná kyselina, glutamát, kortikoliberin aj.). Z neuroanatomického hlediska se zdá pro spuštění panické ataky klíčová role centrálního jádra amygdaly, z nějž vystupuje velké množství drah zapojených do přípravy panické reakce. Oproti tomu protrahované úzkostné ladění je spojeno s aktivací lůžkového jádra striae terminalis. Celý proces je však komplexní a zahrnuje interakce jak s centry mozkového kmene, tak s vyššími centry kortikálními. Jejich role spočívá v modulaci afektivity limbického systému a jeho podřízení volním procesům.
Klíčová slova:
panická porucha – magnetická rezonance – pozitronová emisní tomografie –serotonin – noradrenalin – amygdala – locus coeruleus – prefrontální kůra
Úvod
Panická porucha (PP) patří k nejčastějším úzkostným poruchám s odhadovanou celoživotní prevalencí 3 – 5 % [1]. Je charakterizována rekurentními panickými atakami (PA), tedy ohraničenými epizodami intenzivního strachu, které jsou doprovázeny výraznými somatickými a psychickými příznaky. Záchvaty jsou typické svou náhlostí a spíše kratším trváním v řádu minut, výjimečně hodin. Na počátku onemocnění vyhledávají pacienti většinou ošetření pro své tělesné potíže a dostávají se do kontaktu s odborníky různých specializací, především neurology a internisty. Na PP je tedy možno nahlížet jako na představitele onemocnění s neuropsychiatrickou manifestací. V česko ‑ slovenském odborném písemnictví jsou toho dokladem průkopnické a četné pokračovací práce právě z řad neuropsychiatricky orientovaných neurologů [2]. Kukumberg et al věnovali množství svých příspěvků především diferenciaci PA od tetanických záchvatů jiné etiologie, zvláště neurogenní a hyperventilační tetanie [3]. K plnější orientaci v problematice může přispět rovněž seznámení s neurobiologickými aspekty PP a řízení emocí vůbec. Cílem tohoto článku je přinést přehled současných poznatků o neurobiologii PP a umožnit somaticky orientovaným lékařům ucelenější pohled na mezioborovou problematiku.
Animální modely
Výzkum na zvířatech je navzdory faktu, že není možné objektivní pozorování v animálních modelech plně transformovat na subjektivní lidské prožívání, jedním ze základních nástrojů pro chápání neurobiologických zákonitostí řízení emocí. Strach, úzkost a panika jsou emoční reakce spojené s ohrožením. Zvířecí modely umožňují jejich diferenciaci mj. na základě obranného chování vůči ohrožujícím podnětům. Defenzivní strategie zvířat závisí na bezprostřednosti hrozícího nebezpečí a je možné je rozdělit do tří stupňů, které mají vlastní organizaci a bývají transformovány na lidské emoční stavy (obr. 1).
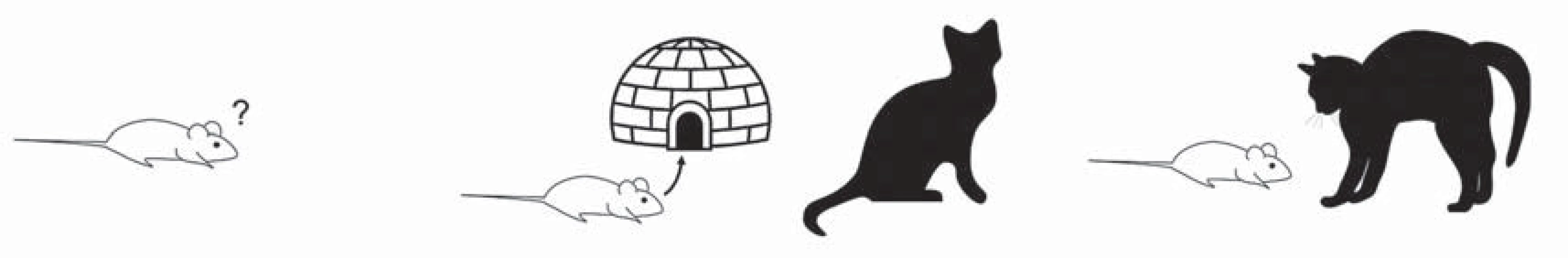
V prvním stupni je ohrožení spojeno s novou neznámou situací, která vede ke zvýšení pozornosti a soustředěnému vyhodnocování rizika. Předpokládá se, že tento stav zvýšené vigility odpovídá úzkostnému prožívání a patologickému stavu příbuznému s generalizovanou úzkostnou poruchou. Ve druhém stupni je pokusné zvíře vystaveno konkrétnímu averzivnímu podnětu (nejčastěji predátorovi), ale ve vzdálenosti, ve které nedochází k přímému ohrožení (tzv. distální ohrožení). Taková situace vede ke snaze vyhnout se konfrontaci a je považována za model konkrétního strachu, který simuluje fobické poruchy. Konečně třetím stupněm ohrožení je bezprostřední vystavení averzivnímu podnětu, tzv. ohrožení proximální, které vede k aktivaci reakce únik nebo útok, případně freezing a které je považováno za ekvivalent prožívání děsu a model panické reakce (volně podle Graeff a Del ‑ Ben [4]).
Neuroanatomické hypotézy
Navzdory nepopíratelné mezidruhové variabilitě ve zpracování ohrožujících podnětů, jsou základní mechanizmy důležité pro zachování života obdobné. U vyšších primátů i hlodavců hrají klíčovou roli tři struktury: amygdalární jádra, hipokampus a mediální prefrontální kůra (PFC) [5].
Přežití každého jednotlivce je v přírodě spojeno s procesem učení. Averzivní stimuly, s nimiž se setkává, jsou v zájmu lepší budoucí predikce asociovány s okolnostmi jejich výskytu. Svázány mohou být buď s konkrétními, současně působícími podněty (ve zvířecím modelu např. tón ohlašující kontakt s predátorem), které se stávají tzv. podmíněnými stimuly, nebo s komplexními vjemy okolního prostředí (např. s prostředím pokusné klece), jež se stávají kontextuálními podmíněnými stimuly. Opakované setkání s konkrétními podmíněnými stimuly je pak zdrojem prožívání fázického strachu. Naopak rozpoznávání kontextuálních podmíněných stimulů je spojeno s časově protrahovaným pocitem ohrožení – úzkostí [6]. Zatímco podmíněné stimuly jsou závislé na zpracování v amygdalárních jádrech, podmíněné kontextové informace vyžadují účast hipokampu [7].
Mimo vytváření účelných podmíněných reakcí je pro organizaci chování důležitý také zánik reakcí neúčelných. Vyhasnutí, resp. přeučení takové podmíněné reakce vyžaduje plasticitu v mediální PFC a v bazolaterální amygdale [8]. Milad a Rauch na základě studia neurozobrazovacích metod konstatují, že úzkostné poruchy, které vykazují neadekvátní reakce na minimálně ohrožující podněty, jsou spojeny právě s hypoaktivitou ve zmíněných prefrontálních oblastech [9].
Uplatnění jednotlivých obranných strategií je potom ve zjednodušenosti dáno poměrem aktivity vyšších nervových center PFC a limbického systému představovaného zde amygdalo ‑ hipokampálním komplexem. Čím vyšší převaha aktivity korových center nad podkorovými, tím vyšší kontrola afektivních impulzů a jejich podřízenost vědomým složkám chování. Takto je charakterizován klidový stav organizmu. V regulačních okruzích dochází k relativní dezinhibici serotonergních rafeálních jader mozkového kmene, která tlumí aktivitu adrenergního locus coeruleus (LC) i senzitivitu amygdalo ‑ hipokampálního okruhu vůči diskriminaci averzivních podnětů. V relativní hypoaktivitě jsou rovněž paraventrikulární jádra hypothalamu a související HPA osa včetně sekrece kortizolu (schéma 1).

Při vystavení konkrétnímu averzivnímu podnětu vyhodnocují amygdalární jádra míru jeho nebezpečnosti a aktivují noradrenergní neurony locus coeruleus. Zvýšená aktivita LC tlumí firing rafeálních jader a tím aktivuje amygdalo ‑ hipokampální okruhy. Aktivované amygdalo ‑ hipokampální okruhy zvyšují citlivost při rozeznávání averzivních podnětů a jejich paměťovém zpracování. Dochází ke zvýšené produkci CRH a kortizolu. Aktivita limbických okruhů převládá nad afektivní kontrolou uplatňovanou z prefrontálních oblastí. Organizmus se dostává do stavu vybuzení a je připraven k obranné reakci (schéma 2) [10].

Konkrétní uplatňované mechanizmy různých emočních i patologických stavů se pak v jednotlivostech liší. Jednu z mála ucelených neuroanatomických teorií PP přinesli v roce 1989 a v revidované podobě v roce 2000 Gorman et al [11,12]. V Gormanově teorii PP má klíčové postavení centrální jádro amygdaly. Sem přicházejí senzorické informace po průchodu thalamem, částečném kortikálním zpracování a analýze v bazolaterálním jádru amygdaly. Odtud vystupuje velké množství projekcí zapojených do přípravy panické odpovědi [13]. Eferentní dráhy centrálního jádra amygdaly inervují parabrachiální jádro, které zvyšuje respirační frekvenci, laterální jádro hypothalamu, jež aktivuje sympatický nervový systém, a LC, který zvyšuje aktivitu noradrenergního systému, podílí se na zvýšení srdeční frekvence a krevního tlaku, stejně jako na behaviorální reakci na ohrožení. Inervují rovněž paraventrikulární jádro hypothalamu, kde cestou HPA osy stimulují uvolňování adrenokortikoidů, a periakveduktální šeď (PAG), kde iniciují obranné chování [12].
Stimulace PAG v animálních modelech vyvolává stejnou reakci jako vystavení zvířete do přímého kontaktu s predátorem, tj. freezing, útok nebo útěk. Rovněž elektrická stimulace PAG u neurochirurgických pacientů vyvolává panikoidní symptomy [14]. Zapojení PAG v akutní reakci na ohrožení podporují též humánní nálezy fMR. Jejich výsledky ukazují, že při experimentálním vystavení virtuálnímu predátorovi dochází spolu s jeho přibližováním k přesunu aktivity z ventromediální PFC směrem do PAG. To odpovídá evoluční potřebě vyhledávat v případě vzdálenějšího ohrožení nejlepší řešení situace, zatímco v případě přímého ohrožení zvolit nejjednodušší strategii směřující k přežití [15].
Také novější neurobiologické hypotézy úzkostných poruch potvrzují, že obvyklé projevy PA se překrývají především s důsledky aktivace centrálního jádra amygdaly, zatímco protrahované úzkostné ladění je spojeno s aktivací lůžkového jádra striae terminalis (patří do oblasti tzv. rozšířené amygdaly) [16,17]. Celý proces je však komplexnější a zahrnuje již zmíněné interakce jednak s „nižšími“ kmenovými centry, jednak s „vyššími“ centry kortikálními [12].
Narušení kortikálního zpracování souvisí na jedné straně s vyhodnocováním vnějších rizik, na druhé straně s analýzou interoceptivních informací. Ta probíhá v „interoceptivním kortexu“, tedy v oblasti přední inzuly, která je v úzkém spojení s přední cingulární kůrou, hypothalamem, amygdalou a orbitofrontálním kortexem. Narušení inzulární aktivity spolu s vyšší senzitivitou vůči somatickým senzacím se kromě PP vyskytuje také u jiných úzkostných poruch [18]. Navazující chybná interpretace těchto akcentovaných senzorických informací v oblasti mediální prefrontální kůry pak aktivuje skrze amygdalární jádra celý „okruh strachu“.
Medikace jako SSRI ovlivňuje zvláště serotoninové projekce z kmenových jader a snižuje tak aktivitu amygdaly a její schopnost aktivovat další centra zapojená do manifestace poruchy. Psychoterapie, zvláště kognitivně‑behaviorální, operuje spíše na vyšší úrovni neurokognitivního zpracování, kde zprostředkovává vyhasnutí, resp. přeučení dysfunkčních podmíněných reakcí a umožňuje uplatnění tlumivého vlivu na amygdalárníjádra [12].
Role neurotransmiterů a jejich receptorů
Serotonin (5 - HT)
Na neurotransmiterové úrovni na sebe soustřeďuje dlouhodobě pozornost především serotonergní systém. Pro PP byly postupně navrženy dvě protichůdné hypotézy serotoninové dysfunkce, jejichž porovnání se věnuje práce Marona a Shlika [19].
Starší teorie zvýšené serotoninové aktivity předpokládá, že u PP dochází ke zvýšenému uvolňování serotoninu nebo hypersenzitivitě postsynaptických 5 - HT receptorů. Novější teorie deficitní serotoninové funkce vychází zase z předpokladu, že serotonin v některých oblastech mozku (např. v dorzální PAG) brzdí rozvoj panické symptomatiky a že je PP spojena s deficitem serotoninu. Maron a Shlik se na základě shrnutí dosavadních nálezů přiklánějí k druhému názoru, tedy že serotonin má specifický inhibiční účinek na panickou reaktivitu. Nicméně vzhledem k množství důkazů podporujících obě teorie doporučují další výzkum [19].
S jiným vysvětlením přišli autoři hypotézy o duální roli serotoninu, která odlišuje funkci serotoninu v řízení úzkosti od jeho funkce v řízení paniky. Podle ní vede aktivace dorzálních rafeálních jader k facilitaci obranných strategií integrovaných v amygdale (úzkost a vyhýbání), ale také k inhibici obranných strategií organizovaných dorzální PAG (útěk, útok, freezing). Adaptivita těchto funkcí může spočívat v tendenci inhibovat extrémní obranné reakce za situace pouze potenciálního či vzdáleného ohrožení, kdy by „panické“ jednání působilo kontraproduktivně a zvýšilo by pravděpodobnost detekce predátorem. Místo toho jsou podporovány naučené postupy, které umožňují konfrontaci s predátorem se vyhnout [20].
Mezi serotoninovými receptory soustřeďují nejvíce pozornosti 5 - HT1A receptory, jejichž role v mediaci úzkosti byla opakovaně prokázána. Ve studii s PET vykazovali neléčení pacienti s PP ve srovnání se zdravými kontrolami sníženou vazbu radioligandu na presynaptické 5 - HT1A receptory v rafeální oblasti a dále postsynapticky v orbitrofrontální kůře, temporálním laloku a amygdale. Úspěšně zaléčení pacienti v remisi naproti tomu vykazovali sníženou vazbu radioligandu pouze v presynaptické oblasti rafeálních jader [21]. Maron a Shlik interpretují nález snížené presynaptické vazby v rafeálních jádrech jako možný kompenzační proces, který má za cíl zvýšit uvolňování serotoninu v místě terminálních projekcí, v případě PP zvláště v oblasti PAG [19].
Noradrenalin
Serotonergní systém mozku pracuje v úzkém sepětí se systémem noradrenergním a vzájemně se přímo i nepřímo ovlivňují. Někteří autoři vidí ve vzájemné dysregulaci těchto systémů podstatu úzkostných poruch. Předpokládají, že úzkost pramení z hyperaktivity noradrenergního a hypoaktivity serotonergního systému – viz také neuroanatomické hypotézy [22]. Tomu odpovídají rovněž experimentální výsledky. Yohimbin, antagonista alfa‑2 autoreceptorů, který zvyšuje synaptickou dostupnost noradrenalinu, provokuje panické symptomy u zdravých dobrovolníků [23]. Naopak klonidin, agonista alfa‑2 receptorů, blokuje u části pacientů s PP manifestaci PA po podání provokační laktátové infuze [24].
Kortikoliberin
Kortikoliberin (CRH) je nejen působkem HPA osy, ale také významným neurotransmiterem, který se kromě paraventrikulárních jader hypothalamu vyskytuje v limbickém systému, zvláště v centrálním jádru amygdaly a lůžkovém jádru striae terminalis [25]. Mezi jinými účinky je považován za modulátora ostatních neurotransmiterových systémů, zvl. serotoninového, noradrenalinového, glutamátového a dopaminového [26]. V animálních modelech prokázali Butler et al schopnost CRH vyvolat anxiogenní projevy spojené s aktivací noradrenergního locus coeruleus [27], naopak Shekhar et al prokázali schopnost antagonisty CRH1 - receptorů tlumit panikoidní reakci vyvolanou podáním laktátu sodného [28].
Glutamát
Glutamát je hlavním excitačním neurotransmiterem CNS. Rovnováha mezi glutamátem a inhibičním gabaergním systémem je pro aktivitu amygdaly považována za klíčovou [29]. Rozsáhlá projekce i vliv glutamátergního systému způsobuje, že jsou ionotropní NMDA a AMPA glutamátové receptory obtížným cílem pro intervenci. Pozornost se proto soustřeďuje na později objevené metabotropní receptory, jejichž funkcí je podle subtypu pozitivní či negativní modulace glutamátergní transmise [30]. Některé látky, které touto cestou snižují aktivitu glutamátového systému, prokázaly v animálních i humánních modelech svůj anxiolytický účinek.
Gamaaminomáselná kyselina (GABA)
Další možností tlumení úzkosti je aktivace inhibičního GABA ‑ ergního systému a byla podána řada důkazů, že narušení tohoto systému hraje roli také v patofyziologii PP. Látky zvyšující aktivitu GABA, benzodiazepiny stejně jako vigabatrin a tiagabin, mají antipanické působení [31]. Nálezy PET studií u pacientů s PP sice opakovaně dokumentují rozdíly proti zdravým kontrolám při vazbě na benzodiazepinové receptory, výsledky však nejsou konzistentní [32].
Použití panikogenů
Pro výzkum etiopatogeneze PD je důležité zachycení průběhu vlastních panických atak. Protože spontánní PA nelze s jistotou předvídat, používá se často provokace laboratorních panikoidních stavů, které svými projevy spontánní PA značně připomínají. Užívána je řada prostředků, mezi nejčastějšími CO2, laktát sodný, cholecystokinin‑4 (CCK ‑ 4), kofein, izoproterenol a yohimbin [33]. Pro použití těchto panikogenů, ať již aplikovaných nitrožilně či inhalačně, byla vyvinuta řada experimentálních modelů. Některé z těchto modelů fungují exkluzivně u pacientů s PD, zatímco jiné (CCK ‑ 4) vyvolají panickou reakci rovněž u zdravých dobrovolníků [34]. Navzdory užitečnosti takových modelů kritizují někteří autoři přílišné zobecňování jejich výsledků a poukazují na nedostatečnou definici experimentálně provokovaných PA [35].
Za jeden z nejvýhodnějších provokačních testů je považován inhalační test s 35% CO2, na nějž zvýšeně reagují rovněž zdraví příbuzní pacientů s PD. Hypersenzitivita k CO2 tak může představovat genetickou predispozici k PD, a to i bez přítomnosti PD [36]. Pozitivní reakce na inhalaci CO2 vykazují zvláště pacienti s tzv. respirační subtypem PD, při němž se vyskytují min. čtyři z pěti respiračních příznaků (pocity dušení, krátkého dechu, bolest či diskomfort na prsou, pocity znecitlivění/ brnění, strach ze smrti) [37]. S méně jistými výsledky se k vyprovokování PA užívá rovněž hyperventilace [36]. Se sekundární hyperventilací jako reakcí na zaregistrovanou hyperkapnii bývá spojována rovněž inhalace CO2. Přesto je kauzální role hyperventilace v provokaci skutečných PA někdy zpochybňována a interpretována nejen jako možná příčina, ale pouze korelát či důsledek PA. Je možné, že hypersenzitivita k CO2 či hyperventilace mohou hrát odlišnou roli u různých subtypů PP [38]. Podobný mechanizmus účinku bývá spojován také s působením laktátu sodného, který se může metabolizovat na bikarbonát a následně CO2 [39]. Jiným společným vysvětlením efektu hyperventilace a laktátové infuze je nadměrná produkce laktátu v odpovědi na vyvolanou alkalózu buď respiračního původu (hyperventilace), nebo původu metabolického (laktátová infuze) [40]. Příčinou PA však nemusí být narušení funkce regulačních dechových center mozkového kmene, ale psychická porucha na vyšší úrovni spočívající v misinterpretaci (katastrofickém zpracování) drobných dechových abnormit a nepřiměřené emoční reakci na ně [38].
Kleinova teorie signálu dušení
Klein už v roce 1993 učinil pokus o integraci nálezů spojujících PP s hyperventilací a provokačními testy využívajícími laktátové infuze či inhalace CO2 [41]. Podle něj představuje PA falešný signál dušení, který je způsoben epizodickou dysfunkcí endogenního opioidního systému, jenž chápe jako fylogeneticky starý systém podílející se na řízení dechových funkcí. V novějším přehledovém článku na vybraných studiích dokládá, že hyperkapnie i hypoxie jsou spojeny právě s aktivací endogenního opioidního systému [42].
Argumentem pro spojování PP s falešnými signály dušení je také chybějící aktivace HPA ‑ osy v průběhu PA. Jak shrnují Graeff et al [43], ani přirozené PA ani látkami vyprovokované PA neaktivují HPA osu. Naopak, fenfluramin či kofein, které potencují úzkost u zdravých dobrovolníků i panických pacientů, zvyšují hladinu stresových hormonů bez ohledu na provokaci panického záchvatu. Panická ataka tedy není na rozdíl od anticipační úzkosti spojena se zvýšenou aktivitou HPA osy. Tento fakt může nepřímo ukazovat na existenci centra detekce dušení. Aktivace HPA osy v případě dušení je totiž kontraproduktivní vzhledem ke zvýšení katabolické aktivity a dalším nárokům na kyslík [42].
Zobrazovací metody CNS
Moderní zobrazovací metody, ať již strukturální či především funkční, jsou významným nástrojem při poznávání neurobiologických podkladů duševních poruch. Navzdory stoupajícímu počtu prací zkoumajících panickou poruchu je zobecnění jejich poznatků problematické. Etiopatogeneze poruchy není plně objasněna, zpracování emočních podnětů je velmi komplexní proces, potenciálních významných struktur je řada a v různých oblastech mozku. Panická porucha je onemocnění záchvatovité, zachycení spontánních panických atak je obtížné, a problematická je také interpretace nálezů spojených s hyperventilací. Statistická síla jednotlivých studií je obvykle velmi nízká (řádově jednotky, výjimečně desítky účastníků), design rozdílný a výsledky heterogenní.
Morfologické nálezy zachycují zmenšený objem amygdaly, hipokampu a parahipokampální kůry, přední cingulární kůry, inzuly, putamen a také frontální a orbitofrontální kůry, a naopak zvětšení objemu v oblasti rostrálního pontu [44].
Klidové funkční studie v mimozáchvatovém období vykazují jako nejvíce konzistentní abnormní nálezy v hipokampální a parahipokampálních oblastech, zatímco změny v temporálních oblastech, zvláště amygdale, a ve frontální oblasti jsou méně konzistentní. Funkční studie zkoumající průběh emočního zpracování ohrožujících podnětů, jehož narušení bývá spojováno se vznikem PD, přinášejí rovněž nejednoznačné výsledky, zejména v otázce zvýšení či snížení aktivity jednotlivých center okruhu strachu. Konzistentnějším nálezem je pouze zvýšená aktivace cingulární kůry [45].
Funkční studie v průběhu provokovaných PA zachytily odchylky především v oblasti cingulární, inzulární a frontální kůry spolu s oblastmi mozkového kmene [45]. V literatuře byly dosud popsány rovněž záznamy čtyř úplných spontánních PA, avšak za rozdílných klinických uspořádání. Ve třech případech byla zjištěna zvýšená amygdalární aktivita, v jednom snížená aktivita temporální, nálezy v ostatních oblastech byly opět nekonzistentní [46 – 49]. Opakovaný nález zvýšené amygdalární aktivity u spontánních PA a nejistých změn amygdalární aktivity u provokovaných PA podporuje možnost rozdílného základu obou stavů [45].
Genetika panické poruchy
Úzkostné poruchy mají mezi duševními poruchami nejnižší heritabilitu. Genetických studií je málo, soubory jsou nevelké, metodiky se liší a subtypy jednotlivých poruch mají pravděpodobně rozdílný genetický základ [50]. Genetické studie tak navzdory pokroku a růstu dat nepřinášejí jednoznačný vhled do patofyziologie PD.
Panická porucha je onemocnění familiární a dědičné. Metaanalýza pěti genetických studií konstatuje signifikantní spojení mezi probandy s PD a výskytem PD u jejich příbuzných prvního řádu s odds ratio 5,0 a rizikem PD u příbuzných probandů s PD 10,0 % ve srovnání s 2,1 % u příbuzných kontrolního souboru. Odhad heritability panické poruchy činí 0,28, zbylá variance fenotypu je určována z 0,70 individuálními a z 0,02 sdílenými faktory prostředí [51]. Asociační studie zkoumající současný výskyt fenotypických znaků se specifickými genetickými variantami stanovily přes 350 kandidátských genů, z nichž však naprostá většina s výjimkou Val158Met polymorfizmu pro katechol ‑ O ‑ metyltransferázu (COMT) vyzněla negativně, inkonzistentně nebo pouze nebyla replikována [52]. Val158Met polymorfizmus pro COMT však není specifickým nálezem u PP, ale je prokazován u řady dalších psychických poruch. COMT je metylační enzym zapojený v metabolizmu monoaminergních neurotransmiterů a má pleiotropní efekt na lidské chování [53].
Závěr
Úzkostné ladění, konkrétní strach i reakce útěk nebo útok mají rozdílnou neurobiologickou organizaci, v níž zúčastněné neurotransmiterové systémy mohou plnit odlišnou roli. Panická porucha má zřejmě nejblíže k mechanizmům spojeným s identifikací přímého ohrožení a s reakcí útěk nebo útok. Podobně jako u jiných afektivních stavů lze i tady zjednodušeně uvažovat o několika vzájemně propojených úrovních řízení: o vědomé kontrole spojené s činností prefrontální kůry, o emočním zabarvení spojeném s aktivitou limbického systému a o somatických projevech spojených s aktivitou nižších, převážně kmenových center. V případě panické poruchy se zdá být průsečíkem všech zúčastněných mechanizmů centrální jádro amygdaly. K panické poruše může přispívat narušení na kterékoliv z těchto úrovní. Různé způsoby terapie se mohou svým zaměřením lišit. Navzdory obecnému porozumění těmto mechanizmům zůstává stále mnoho protikladů a neznámých, na něž by mohl odpovědět další výzkum.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petr Šilhán
Oddělení psychiatrické
FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: petr.silhan@fno.cz
Přijato k recenzi: 11. 7. 2013
Přijato do tisku: 28. 1. 2014
Zdroje
1. Hirschfeld RM. Panic Disorder: diagnosis, epidemiology, and clinical course. J Clin Psychiatry 1996; 57 (Suppl 10): 3 – 8.
2. Kukumberg P. Panická porucha: psychoneurologický nexus. Ceska Slov Psychiatr 1994; 90(3): 142 – 145.
3. Kukumberg P. Panická porucha – Neuropsychiatrický profil. Cesk Slov Neurol N 2007; 70/ 103(1): 6 – 15.
4. Graeff FG, Del ‑ Ben CM. Neurobiology of panic disorder: from animal models to brain neuroimaging. Neurosci Biobehav Rev 2008; 32(7): 1326 – 1335. doi: 10.1016/ j.neubiorev.2008.05.017.
5. Sullivan GM, Debiec J, Bush DEA, Lyons DM, Ledoux JE.The Neurobiology of fear and anxiety: contributions of animal models to current understanding. In: Charney DS, Nestler EJ. Neurobiology of Mental Illness. 3rd ed. New York: Oxford University Press 2009 : 603 – 626.
6. Grillon C. Models and mechanisms of anxiety: evidence from startle studies. Psychopharmacology (Berl) 2008; 199(3): 421 – 437.
7. Sullivan GM, Coplan JD, Kent JM, Gorman JM. The noradrenergic system in pathological anxiety: a focus on panic with relevance to generalized anxiety and phobias. Biol Psychiatry 1999; 46(9): 1205 – 1218.
8. Akirav I, Maroun M. The role of the medial prefrontal cortex ‑ amygdala circuit in stress effects on the extinction of fear. Neural Plast 2007; 2007 : 30873.
9. Milad MR, Rauch SL. The role of the orbitofrontal cortex in anxiety disorders. Ann N Y Acad Sci 2007; 1121 : 546 – 561.
10. Ressler KJ, Nemeroff CB. Role of serotonergic and noradrenergic systems in the pathophysiology of depression and anxiety disorders. Depress Anxiety 2000; 12 (Suppl 1): 2 – 19.
11. Gorman JM, Liebowitz MR, Fyer AJ, Stein J. A neuroanatomical hypothesis for panic disorder. Am J Psychiatry 1989; 146(2): 148 – 161.
12. Gorman JM, Kent JM, Sullivan GM, Coplan JD. Neuroanatomical hypothesis of panic disorder, revised. Am J Psychiatry 2000; 157(4): 493 – 505.
13. Pitkänen A, Savander V, LeDoux JE. Organization of intra ‑ amygdaloid circuitries in the rat: an emerging framework for understanding functions of the amygdala. Trends Neurosci 1997; 20(11): 517 – 523.
14. Del ‑ Ben CM, Graeff FG. Panic disorder: is the PAG involved? Neural Plast 2009; 2009 : 108135. doi: 10.1155/ 2009/ 108135.
15. Mobbs D, Petrovic P, Marchant JL, Hassabis D, Weiskopf N, Seymour B et al. When fear is near: threat imminence elicits prefrontal ‑ periaqueductal gray shifts in humans. Science 2007; 317(5841): 1079 – 1083.
16. Walker DL, Toufexis DJ, Davis M. Role of the bed nucleus of the stria terminalis versus the amygdala in fear, stress, and anxiety. Eur J Pharmacol 2003; 463(1 – 3): 199 – 216.
17. Walker DL, Miles LA, Davis M. Selective participation of the bed nucleus of the stria terminalis and CRF in sustained anxiety‑like versus phasic fear‑like responses. Prog Neuropsychopharmacol Biol Psychiatry 2009; 33(8): 1291 – 308. doi: 10.1016/ j.pnpbp.2009.06.022.
18. Domschke K, Stevens S, Pfleiderer B, Gerlach AL. Interoceptive sensitivity in anxiety and anxiety disorders: an overview and integration of neurobiological findings. Clin Psychol Rev 2010; 30(1): 1 – 11. doi: 10.1016/ j.cpr.2009.08.008.
19. Maron E, Shlik J. Serotonin function in panic disorder: important, but why? Neuropsychopharmacology 2006; 31(1): 1 – 11.
20. Graeff FG. On serotonin and experimental anxiety. Psychopharmacology (Berl) 2002; 163(3 – 4): 467 – 476.
21. Nash JR, Sargent PA, Rabiner EA, Hood SD, Argyropoulos SV, Potokar JP et al. Serotonin 5 – HT1A receptor binding in people with panic disorder: positron emission tomography study. Br J Psychiatry 2008; 193(3): 229 – 234. doi: 10.1192/ bjp.bp.107.041186.
22. Gorman JM, Hirschfeld RM, Ninan PT. New Developments in the Neurobiological Basis of Anxiety Disorders. Psychopharmacology Bulletin 2002; 36 (Suppl 2): 49 – 67.
23. Vasa RA, Pine DS, Masten CL, Vythilingam M, Collin C, Charney DS et al. Effects of yohimbine and hydrocortisone on panic symptoms, autonomic responses, and attention to threat in healthy adults. Psychopharmacology (Berl) 2009; 204(3): 445 – 455. doi: 10.1007/ s00213 – 009 – 1475 – x.
24. Coplan JD, Liebowitz MR, Gorman JM, Fyer AJ, Dillon DJ, Campeas RB et al. Noradrenergic function in panic disorder. Effects of intravenous clonidine pretreatment on lactate induced panic. Biol Psychiatry 1992; 31(2): 135 – 146.
25. Sullivan GM, Coplan JD, Kent JM, Gorman JM. The noradrenergic system in pathological anxiety: a focus on panic with relevance to generalized anxiety and phobias. Biol Psychiatry 1999; 46(9): 1205 – 1218.
26. Risbrough VB, Stein MB. Role of corticotropin releasing factor in anxiety disorders: a translational research perspective. Horm Behav 2006; 50(4): 550 – 561.
27. Butler PD, Weiss JM, Stout JC, Nemeroff CB. Corticotropin‑releasing factor produces fear ‑ enhancing and behavioral activating effects following infusion into the locus coeruleus. J Neurosci 1990; 10(1): 176 – 183.
28. Shekhar A, Johnson PL, Fitz SD, Nakazato A, Chaki S,Steckler T et al. A selective, non‑peptide CRF receptor 1 antagonist prevents sodium lactate‑induced acute panic‑like responses. Int J Neuropsychopharmacol 2011; 14(3): 355 – 365. doi: 10.1017/ S1461145710001355.
29. Shekhar A, Truitt W, Rainnie D, Sajdyk T. Role of stress, corticotrophin releasing factor (CRF) and amygdala plasticity in chronic anxiety. Stress 2005; 8(4): 209 – 219.
30. Nordquist RE, Steckler T, Wettstein JG, Mackie C, Spooren W. Metabotropic glutamate receptor modulation, translational methods, and biomarkers: relationships with anxiety. Psychopharmacology (Berl) 2008; 199(3): 389 – 402. doi: 10.1007/ s00213 – 008 – 1096 – 9.
31. Zwanzger P, Rupprecht R. Selective GABAergic treatment for panic? Investigations in experimental panic induction and panic disorder. J Psychiatry Neurosci 2005; 30(3): 167 – 175.
32. Hasler G, Nugent AC, Carlson PJ, Carson RE, Geraci M, Drevets WC. Altered cerebral gamma ‑ aminobutyric acid type A ‑ benzodiazepine receptor binding in panic disorder determined by [11C] flumazenil positron emission tomography. Arch Gen Psychiatry 2008; 65(10): 1166 – 1175. doi: 10.1001/ archpsyc.65.10.1166.
33. Valença AM, Nardi AE, Nascimento I, Zin WA, Versiani M. Carbon dioxide test as an additional clinical measure of treatment response in panic disorder. Arq Neuropsiquiatr 2002; 60(2 – B): 358 – 361.
34. Nordquist RE, Steckler T, Wettstein JG, Mackie C, Spooren W. Metabotropic glutamate receptor modulation, translational methods, and biomarkers: relationships with anxiety. Psychopharmacology 2008; 199(3): 389 – 402. doi: 10.1007/ s00213 - 008 - 1096 - 9.
35. Nardi AE, Valença AM, Lopes LL, de ‑ Melo ‑ Neto VL, Freire RC, Veras AB et al. Caffeine and 35% carbon dioxide challenge tests in panic disorder. Hum Psychopharmacol Clin Exp 2007; 22(4): 231 – 240.
36. Sardinha A, Freire RC, Zin WA, Nardi AE. Respiratory manifestations of panic disorder: causes, consequences and therapeutic implications. J Bras Pneumol 2009; 35(7): 698 – 708.
37. Valença AM, Nardi AE, Nascimento I, Zin WA, Versiani M. Respiratory panic disorder subtype and sensitivity to the carbon dioxide challenge test. Braz J Med Biol Res 2002; 35(7): 783 – 788.
38. Freire RC, Nardi AE. Panic disorder and the respiratory system: clinical subtype and challenge tests. Rev Bras Psiquiatr 2012; 34 (Suppl 1): S32 – S41.
39. Battaglia M, Ogliari A. Anxiety and panic: from human studies to animal research and back. Neurosci Biobehav Rev 2005; 29(1): 169 – 179.
40. Maddock RJ. The lactic acid response to alkalosis in panic disorder: an integrative review. J Neuropsychiatry Clin Neurosci 2001; 13(1): 22 – 34.
41. Klein DF. False suffocation alarms, spontaneous panics, and related conditions. An integrative hypothesis. Arch Gen Psychiatry 1993; 50(4): 306 – 317.
42. Preter M, Klein DF. Panic, suffocation false alarms, separation anxiety and endogenous opioids. Prog Neuropsychopharmacol Biol Psychiatry 2008; 32(3): 603 – 612.
43. Graeff FG, Garcia ‑ Leal C, Del ‑ Ben CM, Guimarães FS.Does the panic attack activate the hypothalamic ‑ pituitary‑adrenal axis? An Acad Bras Cienc 2005; 77(3): 477 – 491.
44. Del Casale A, Serata D, Rapinesi C, Kotzalidis GD, Angeletti G, Tatarelli R et al. Structural neuroimaging in patients with panic disorder: findings and limitations of recent studies. Psychiatr Danub 2013; 25(2): 108 – 114.
45. Dresler T, Guhn A, Tupak SV, Ehlis AC, Herrmann MJ,Fallgatter AJ et al. Revise the revised? New dimensions of the neuroanatomical hypothesis of panic disorder. J Neural Transm 2013; 120(1): 3 – 29. doi: 10.1007/ s00702 – 012 – 0811 – 1.
46. Fischer H, Andersson JL, Furmark T, Fredrikson M.Brain correlates of an unexpected panic attack: a human positron emission tomographic study. Neurosci Lett 1998; 251(2): 137 – 140.
47. Pfleiderer B, Zinkirciran S, Arolt V, Heindel W, Deckert J, Domschke K. fMRI amygdala activation during a spontaneous panic attack in a patient with panic disorder. World J Biol Psychiatry 2007; 8(4): 269 – 272.
48. Dresler T, Hahn T, Plichta MM, Ernst LH, Tupak SV, Ehlis AC et al. Neural correlates of spontaneous panic attacks. J Neural Transm 2011; 118(2): 263 – 269. doi: 10.1007/ s00702 - 010 - 0540 - 2.
49. Spiegelhalder K, Hornyak M, Kyle SD, Paul D, Blechert J, Seifritz E et al. Cerebral correlates of heart rate variations during a spontaneous panic attack in the fMRI scanner. Neurocase 2009; 15(6): 527 – 534. doi: 10.1080/ 13554790903066909.
50. Hosák L, Šilhán P, Hosáková J. Genetika úzkostných poruch. Psychiatr Prax 2013; 14(1): 7 – 9.
51. Hettema JM, Prescott CA, Myers JM, Neale MC, Kendler KS. The structure of genetic and environmental risk factors for anxiety disorders in men and women. Arch Gen Psychiatry 2005; 62(2): 182 – 189.
52. Maron E, Hettema JM, Shlik J. Advances in molecular genetics of panic disorder. Mol Psychiatry 2010; 15(7): 681 – 701. doi: 10.1038/ mp.2009.145.
53. Hosak L. Role of the COMT gene Val158Met polymorphism in mental disorders: a review. European Psychiatry 2007; 22(5): 276 – 281.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 3
-
Všechny články tohoto čísla
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
-
Komentář ke článku autorů Kotase a Polívky
Přehled méně častých primárních bolestí hlavy - Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Projekt ncRNAPain
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
-
Komentář ke článku autorů Mrliana, Ďuriše, Neumana, Vybíhala a Smrčky
Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení - Pupilární reakce na barevné podněty
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Prof. Josef Vymazal starší – in memoriam
- Webové okénko
- Recenze knih
-
Analýza dat v neurologii
XLV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – III. Spojitá data
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Neurologické hypotézy u panické poruchy
