Léčba recidivy či rezidua multiformního glioblastomu pomocí stereotaktické radiochirurgie gama nožem – společně hodnocený soubor dvou neurochirurgických pracovišť
Gamma knife stereotactic radiosurgery in recurrent or residual glioblastoma multiforme – our experience in two neurosurgical units
This paper is a retrospective analysis of a 33 patient cohort with diagnosis of glioblastoma multiforme treated using gamma knife stereotactic radiation therapy following surgical resection and fractionated radiation therapy. Overall, 35 stereotactic radiation procedures were performed. Within this group, we differentiated patients who benefited from these procedures – we managed to stabilise or achieve remission of the disease in 13 cases (37%) in a 3 month follow-up and in 6 cases (18%) in a 6-month follow-up. Long-term remission of this highly malignant tumor using gamma knife therapy was achieved in 4 patients.
Key words:
gamma knife – glioblastoma multiforme – radiotherapy
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
R. Bartoš 1; O. Šoula 2; G. Šimonová 3; A. Malucelli 1; D. Šmejkalová-Musilová 4; F. Třebický 5; R. Liščák 3; J. Klener 2; M. Sameš 1
Působiště autorů:
Neurochirurgická klinika UJEP, Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
1; Neurochirurgické oddělení, Nemocnice Na Homolce, Praha
2; Oddělení stereotaktické a radiační neurochirurgie, Nemocnice Na Homolce, Praha
3; Onkologické oddělení, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem o. z.
4; Ústav radiační onkologie, Nemocnice Bulovka, Praha
5
Vyšlo v časopise:
Cesk Slov Neurol N 2018; 81(5): 556-562
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn2018556
Souhrn
V této retrospektivní analýze hodnotíme soubor 33 pacientů léčených po operaci a zevní frakcionované radioterapii pro multiformní glioblastom pomocí stereotaktické radiochirurgie gama nožem. Celkem bylo provedeno 35 stereotaktických radiochirurgických výkonů. U části našich pacientů můžeme hodnotit tuto léčbu jako přínosnou, v souboru se podařilo po 3 měsících stabilizovat či zaléčit reziduální/ progredující ložisko ve 13 případech (37 %), po 6 měsících byl nádor stabilní či v regresi u 6 pacientů (18 %) ze souboru. Dlouhodobý efekt léčby gama nožem u této velice nepříznivé diagnózy jsme pozorovali u 4 pacientů.
Klíčová slova:
gama nůž – multiformní glioblastom – radioterapie
Úvod
Prognóza pacientů s multiformním glioblastomem (glioblastoma multiforme; GBM) zůstává velice nepříznivá a každá léčebná modalita, která nevykazuje závažné vedlejší nežádoucí účinky a alespoň u části pacientů se prokáže její benefit, je dle našeho názoru prospěšná. V tomto sdělení se snažíme vyhodnotit soubor pacientů, kteří kromě resekční operace, zevní frakcionované radioterapie (external beam radiation therapy; EXBRT) a chemoterapie absolvovali v některé fázi svého onemocnění léčbu pomocí stereotaktické radiochirurgie (stereotactic radiosurgery; SRS) – doplňující dávku záření (boost). Tak aby byla výpovědní hodnota souboru posílena, do hodnocení jsme zahrnuli pacienty primárně operované a sledované ve dvou centrech. V diskuzi vysvětlujeme koncept leading edge radiosurgery (LERS) u GBM.
Soubor pacientů
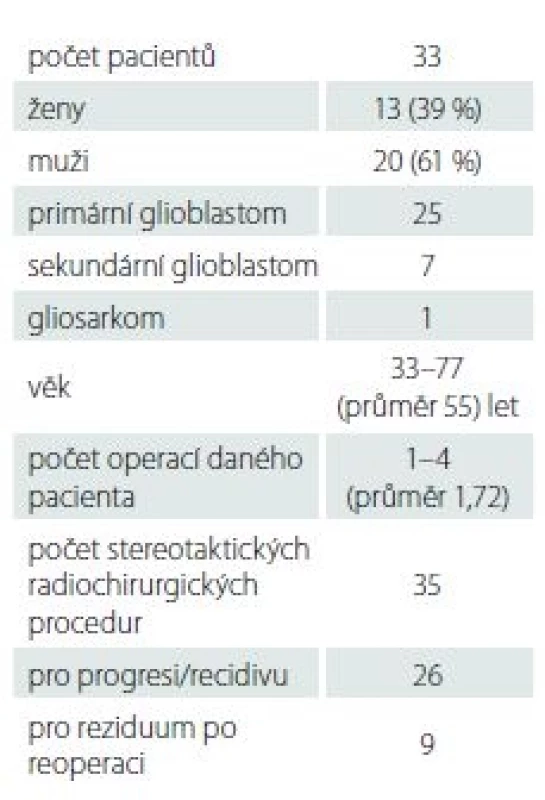
Hodnotíme soubor našich pacientů, kteří byli v období 2012 až 6/ 2017 pro reziduum či recidivu GBM ošetřeni na pracovišti Stereotaktické a radiační neurochirurgie nemocnice Na Homolce v Praze ozářením pomocí gama nože. Minimální doba sledování je 6 měsíců. U 20 pacientů operovaných na neurochirurgickém pracovišti v Ústí nad Labem proběhlo 21 radiochirurgických výkonů. U 13 pacientů operovaných na neurochirurgickém pracovišti nemocnice Na Homolce proběhlo 14 radiochirurgických výkonů. Společný soubor čítá tedy 33 pacientů a 35 SRS procedur. Jedná se o pacienty po 1 – 4 operacích pro GBM (v průměru 1,72), kteří byli v průběhu svého onemocnění ošetřováni SRS pomocí gama nože. Během ní je pacientovi po premedikaci připevněn v lokální anestezii na hlavu stereotaktický rám. Rám je fixován k lebce pomocí čtyř šroubů, které proniknou kůží infiltrovanou lokálním anestetikem a pevně se opřou o lebku. V případě potřeby je rám rotován tak, aby se fixační šrouby vyhnuly místu předchozí trepanace. S ním pacient absolvuje vyšetření MR s indikátorovým boxem fixovaným k rámu. K zaměření se používá T1 SE sekvence po podání paramagnetické kontrastní látky a cílem pro léčbu je nádorová tkáň enhancující po podání kontrastní látky. V případě terapie LERS je použita sekvence fluid attenuation inversion recovery (FLAIR), v tomto souboru ale o tento typ léčby nešlo. Plán léčby je vytvořen tak, že prostorová distribuce radiační dávky konformně odpovídá enhancujícímu nádoru a k tomu lze flexibilně použít potřebný počet izocenter s kombinací 4, 8 a 16mm kolimátoru. Isodosa, na kterou je předepsána min. okrajová dávka, je nejčastěji volena mezi 40 – 50 %. Ozáření je aplikováno v jediné frakci a trvá v řádu desítek min – v závislosti na počtu izocenter, velikosti kolimátoru, objemu ložiska a stáří zdrojů záření 60Co. Bezprostředně po ozáření je rám sejmut z hlavy pacienta a ten odchází domů.
Soubor pacientů hodnotí tab. 1. V souboru bylo 20 mužů a 13 žen, průměrného věku 55 (33–77) let. Z hlediska histologického podtypu se jednalo se o 1 gliosarkom, 25 primárních a 7 sekundárních GBM. Z důvodu heterogenity souboru stran doby ozáření od začátku onemocnění a relativně krátkému sledování u některých pacientů nesledujeme primárně celkové přežití (overall survival; OS) a OS po SRS (OS-SRS), ale analyzujeme dynamiku změn na MR, kterou v rámci následného sledování provádíme. Běžným harmonogramem je snímkování po zhruba 2 – 3 měsících. Výsledný obraz MR hodnotíme v T1 postkontrastních sekvencích jako progredující (pokud dochází ke zvětšení velikosti postkontrastně enhancujícího ložiska), stacionární nález (ložisko se nemění) nebo nález v regresi (dochází ke zmenšení či vymizení postkontrastního enhancementu). OS sledujeme a popisujme kazuisticky pouze u některých pacientů, u kterých zapojení SRS do léčebného procesu dle našeho názoru přineslo kvalitní přežití (Karnofsky performance score; KPS ≥ 60 %) delší 1 roku po SRS. Všichni pacienti, kterým byla MR provedena, dosahovali KPS ≥ 40 %. Za cenný fakt pokládáme, že po 3 měsících byla MR provedena všem pacientům v souboru, po 6 měsících byla z důvodu klinické deteriorace provedena jen 13 pacientům (39 %).
Výsledky
Jednalo se o 9 výkonů SRS pro reziduum po opakované resekci GBM při recidivě (vždy již po primární EXBRT) a 27 výkonů pro recidivu (> 3 měsíce po operaci). V případě recidivy byl průměrný odstup operace od SRS 12,8 (3–38) měsíců. Počet ozářených ložisek byl 1 – 5 (průměr 1,63), průměrná min. dávka na referenční isodose 13,7 (12–17) Gy.
Dynamiku nálezů na MR dokumentuje obr. 1. Po 3 měsících bylo v progresi alespoň jedno ozářené ložisko ve 22 případech (63 %), v 6 případech (17 %) byl nález ozářeného ložiska graficky stabilní a v 7 případech (20 %) došlo k jeho objemové regresi.
d-o – počet pacientů po 3. měsíci graficky nevyšetřovaných; GBM – multiformní glioblastom; SRS – stereotaktická radiochirurgie
Fig. 1. Radiologic follow-up of GBM lesions 3 and 6 months after SRS.
d-o – number of patients with no radiologic control after 3 months; GBM – glioblastoma multiforme; SRS – stereotactic radiosurgery
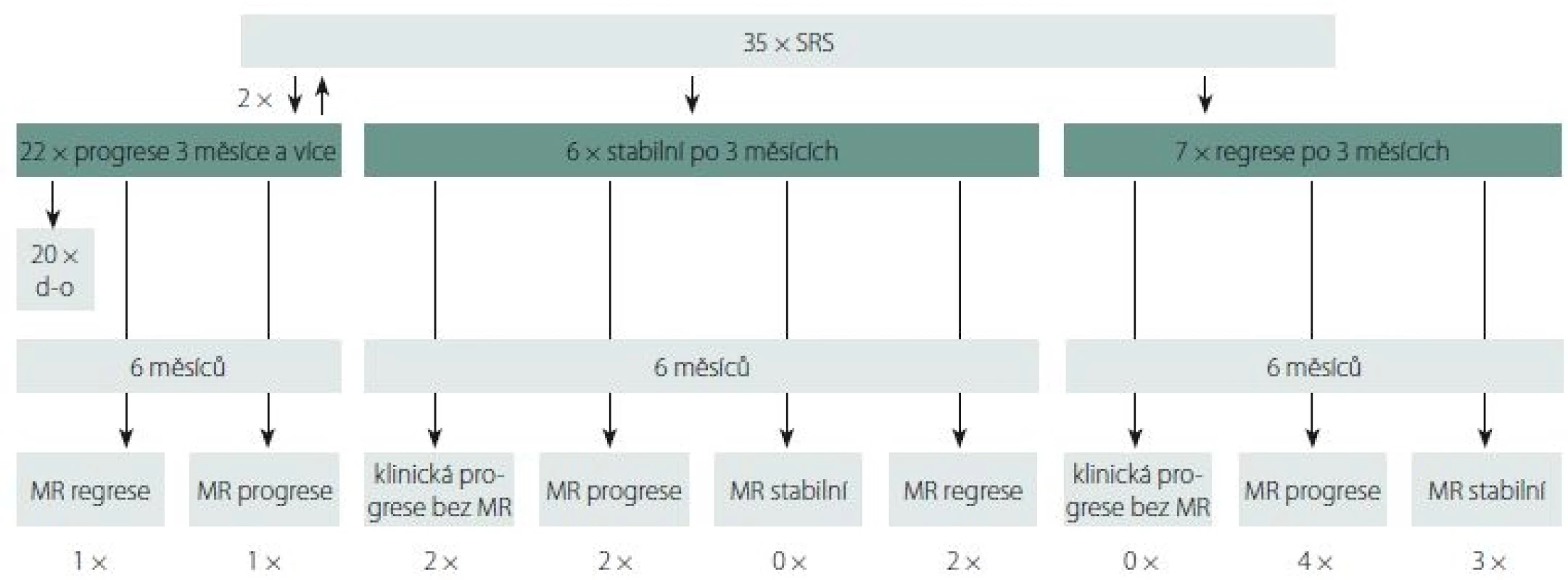
Z šesti ve 3 měsících stabilních ložisek po 6měsíčním sledování progredovala dvě (33 %) – u jednoho z nich byla opět indikována SRS, nicméně s následnou další progresí (v souboru nehodnoceno). Další dva pacienti vypadli z grafického sledování, protože u nich došlo k progresi klinického stavu. U dalších dvou pacientů došlo naopak k objemové regresi.
Ze sedmi ložisek původně v regresi došlo u čtyř pacientů (57 %) k progresi; u jednoho zůstalo ložisko ve stabilní regresi, ale došlo k nevelké progresi v oblasti neozářené SRS, opět indikované k SRS s regresí po 3 měsících (v souboru nehodnoceno) a u dvou pacientek zůstal grafický nález v původní stabilní regresi (29 %). Progrese v jiné oblasti při uspokojivém lokálním nálezu ložiska ošetřeného SRS je poměrně častý problém. V našem souboru nastala u čtyř pacientů (12,1 %) ve 3., 2× v 6. a ve 14. měsíci po SRS.
U jedné pacientky, prezentované v kazuistikách, jsme pozorovali po 3 měsících progresi ložiska ozářeného SRS (histologicky regresívní GBM s nízkým proliferačním indexem) a naopak v 6 měsících došlo k jeho úplnému vymizení, jednalo se pravděpodobně o subakutní postradiační reakci s poruchou hematoenecefalické bariéry. U další pacientky, byť došlo po 3 i 6 měsících k progresi obou ozářených ložisek, zůstával její klinický stav natolik dobrý, že mohla pokračovat v komplexní onkologické léčbě.
Z dlouhodobého hlediska OS-SRS > 1 roku můžeme konstatovat, že z komplexní onkologické léčby, do které byla zahrnuta i SRS, profitovali 4 pacienti z 29 se sledováním delším než 1 rok po SRS (13,8 %). Tyto kazuisticky vyhodnocujeme:
- Jedná se o 61letou pacientku s primárním GBM temporálně vpravo, 2× operovanou pro časnou recidivu a v září 2015 ozářenou boostem SRS pro reziduum nádoru, dokončení EXBRT a chemoterapie II. linie lomustin. Došlo ke kompletní remisi trvající doposud. OS-SRS je 28 měsíců, OS je 39 měsíců (obr. 2).
- Další je 41letý pacient s GBM frontálně vlevo s drobnou recidivou po 6 měsících, ozářenou SRS, po prvních 3 měsících zůstal nález stacionární, ale následně došlo k regresi trvající 14 měsíců. Poté však došlo ke vzniku jiného ložiska GBM temporálně vpravo. Po dobu úplné grafické regrese bylo KPS 80 %. Pacient podstoupil další operaci a dokončil reradioterapii pomocí protonového ozáření (Protonové centrum Praha) s grafickou stabilizací onemocnění 3 měsíce po reradioterapii. OS-SRS je 23 měsíců, OS 29 měsíců.
- Dále se jedná o 44letou pacientku s GBM frontálně vlevo, která v dubnu 2015 podstoupila radikální odstranění tumoru kontralaterálním transfalcinním přístupem frontálně zprava, poté následovala standardní chemo - a radioterapie. Pro recidivu tumoru frontálně vlevo podstoupila SRS v říjnu 2016 a následně v březnu 2017 pro další mírné zvětšování postkontrastních enhancementů. Její klinický stav byl dlouhodobě prakticky bezpříznakový (KPS 90 %). Nicméně pro opětovnou recidivu maligního procesu (s objemově výrazným zvětšením frontálního ložiska) byla v září 2017 provedena opět radikální resekce. Pacientka byla poté léčena 2. řadou chemoterapie a její OS trvá 33 měsíců. Bohužel, její klinický neurologický stav se 3 měsíce po druhé operaci postupně opět zhoršil ve smyslu apaticko/ abulického syndromu, KPS 60 – 70 % a na poslední MR z prosince 2017 je opětovně patrné sycení v okrajích operační dutiny. Můžeme se domnívat, že ačkoli SRS nebyla účinná stran stabilizace/ regrese objemu velikosti nádoru, umožnila zpomalení růstu nádoru a tím zajistila uspokojivý klinický stav pacientky (obr 3).
- Zvláštní průběh pozorujeme u 52leté pacientky se sekundárním GBM temporookcipitálně vlevo, zdravotní sestry, jejíž léčba byla vedena max. snahou o aktivní řešení. Byla od dubna 2016 4× operována a po posledních 2 operacích vždy ozářena pro reziduum pomocí gama nože. Po prvním ozáření došlo k časné progresi ve 3 měsících, po poslední operaci a SRS jsme po 3 měsících pozorovali již inoperabilní MR progresi v oblasti vnitřní capsuly (navzdory Ki-67 0% ze vzorku poslední operace). Další léčbu kromě chemoterapie jsme jí již nemohli nabídnout, po 6 měsících však pozorujeme kompletní regresi nádoru vč. výrazného zlepšení funkčního stavu. OS nyní trvá 21 měsíců (obr. 4).
Fig. 2. 61-year-old female with a GBM in the right temporooccipital region and in mesiotemporal structures (hippocampus) after two
operations using an occipital approach and a third trans-sylvian resection of a progressing residual lesion followed by conventional radio-
and chemotherapy plus SRS boost for a remnant after the last operation.
A – MRI scan (the yellow line marks the reference isodose curve) shows that the contrast enhancing recurrent lesion close to the postsurgical
cavity was irradiated by gamma knife with a safe margin of 1.5–2 mm, the proximity to the postsurgical cavity is an advantage – a fraction
of the whole radiation dose, which would burden healthy adjacent structures increasing the risk of neurological complications, is dispersed
into the postresectional cavity. The distribution of the irradiation reminds anatomically LERS (fasciculus arcuatus region and fimbria fornicis).
B – Long-term good radiologic outcome, the subdural cerebrospinal fluid pseudocyst is not tense, the patient is in a good conditions, KPS 60%,
she needs assistance from her husband, she goes for a walk with him.
GBM – glioblastoma multiforme; KPS – Karnofsky performance score; LERS – leading edge radiosurgery; SRS – stereotactic radiosurgery
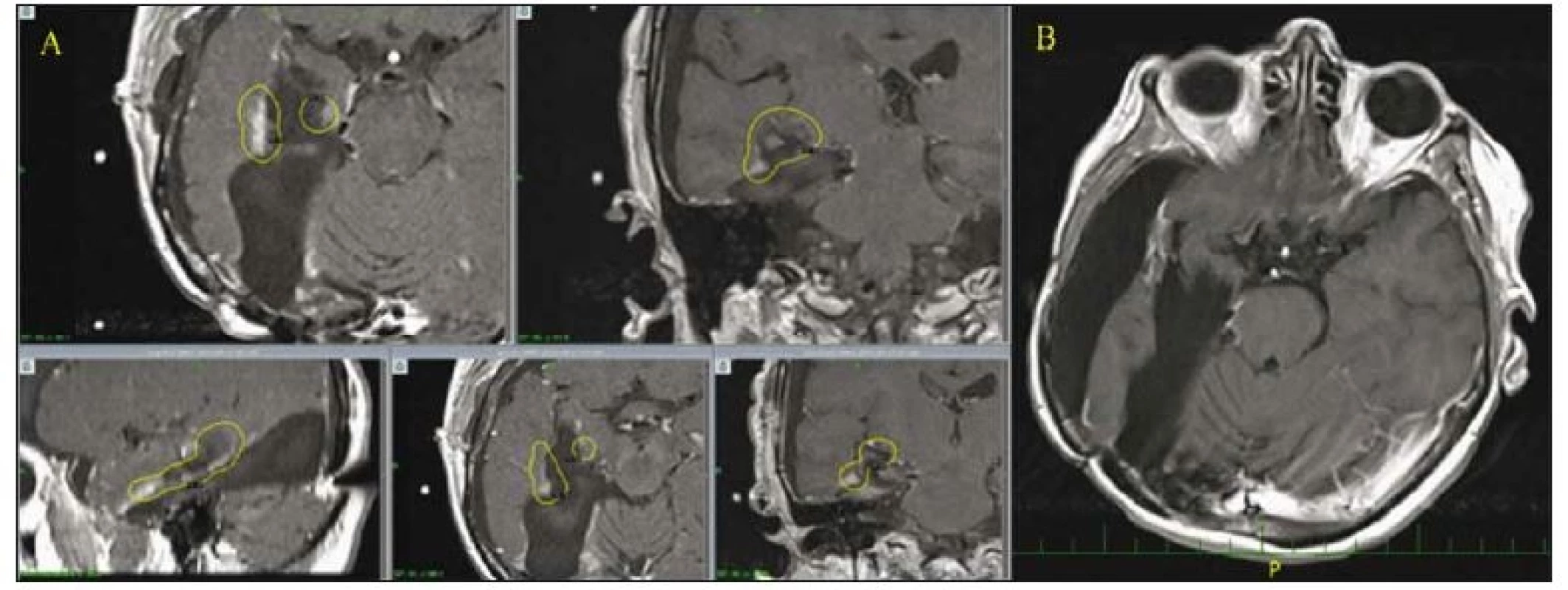
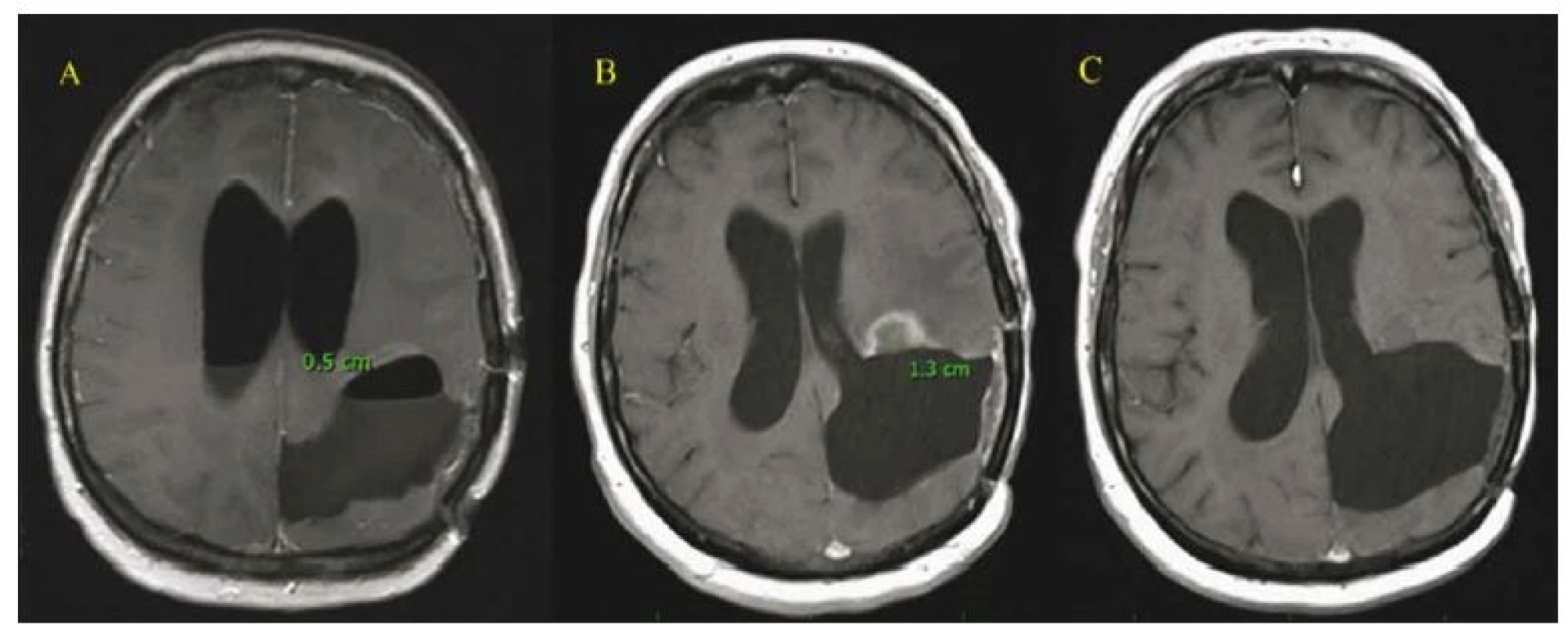
Fig. 3. Radiologic changes of left frontal lesions following repeated irradiation by gamma knife in a female patient after radical transfalcine
resection of a GBM. A – Frontal tumor of the left side before operation. B – After radical transfalcine resection from the right side.
C – Tumor recurrence before SRS. D – Further progression after the first SRS. E – Further progression after the second SRS, nevertheless the good
clinical conditions of the patient allows a second radical resection. F – MRI scan after the second radical resection in this 44-year-old female.
GBM – glioblastoma multiforme; SRS – stereotactic radiosurgery
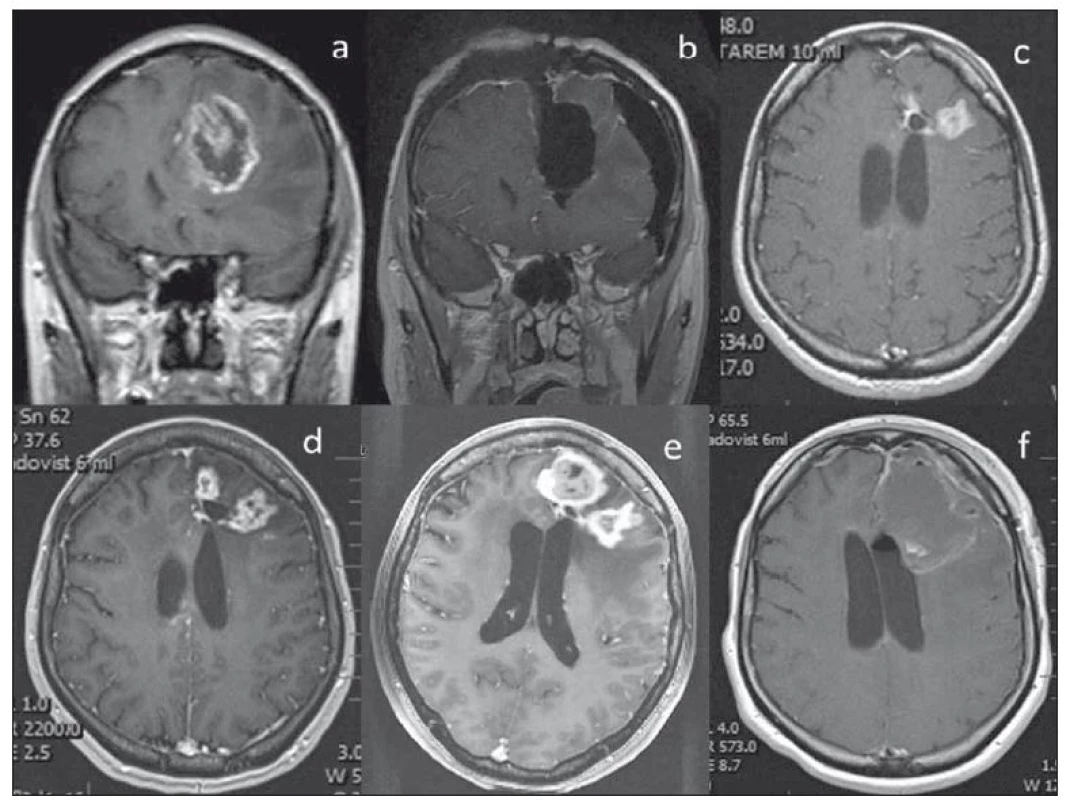
Fig. 4. Radiologic changes of a lesion in the posterior limb of the capsula interna after repeated SRS. The localisation of the lesion close
to the surgical cavity (as in Fig. 2) and a small volume allowed the application of SRS with a higher dose of radiation. The radiologic progression
two months after radiation is probably related to damaged hemato-encephalic barrier and its late repair with radiologic regression
of the lesion (tumor remnant). A – Early postoperative MRI after the 4th operation, resection was stopped after motor stimulation at
5 mA, remnant 5 mm, SRS. B – Pseudoprogression in MRI after 2 months, clinical worsening – hemiparesis, phatic disorder, no surgery was indicated,
corticoids were administered. C – Later regression of the enhancing lesion in MRI accompanied by clinical recovery and interruption
of corticotherapy.
SRS – stereotactic radiosurgery
Možností zařazení stereotaktického boostu do léčby recidivy GBM se zabývá celá řada starších prací [1 – 3]. Práce od autorů Shrieve et al např. SRS hodnotila jako účinnou, ročním i 2letým přežitím zcela srovnatelnou s invazivní brachyterapií [2].
Recentně (2017) byla pracovištěm M. S. Bergera publikována velká retrospektivní studie mající za úkol vyhodnotit efekt a komplikace SRS u recidiv GBM [4]. Jednalo se o kohortu 174 pacientů léčených v období let 1991 – 2013. Rozsah resekce GBM osciloval od radikální resekce (37 %), přes „near-total” resekci (6 %) a parciální resekci (40 %) po biopsii (11 %). Průměrný odstup SRS byl 8,7 měsíce po stanovení iniciální diagnózy první operací. Celkem 75 % pacientů obdrželo léčbu na 1 ložisko/ cíl, nicméně ozařováno bylo až 6 ložisek, střední ozařovaný objem ložiska byl 7,0 (0,3 – 39,0) cm3. Střední doba přežití byla 10,6 měsíců po SRS a 21,1 měsíců po určení diagnózy. Mladší věk, vyšší ozařovací dávka a delší interval mezi původní operací a recidivou nádoru byly pozitivními prognostickými znaky. Histologie gliosarkomu nebyla negativním prognostickým znakem. Celkem 46 pacientů (26 %) prodělalo následnou operaci a histologickým výsledkem byla v 63 % radionekróza a/ nebo smíšený nález (nádor/ nekróza), zatímco v 35 % je jednalo o čistou recidivu nádoru.
Dalšími autory hodnotícími efekt léčby gama nožem na recidivu GBM u 42 pacientů jsou Frisher et al [5]. Výsledky stran přežití jsou obdobné, střední OS od diagnózy 25,6 měsíce, po SRS 9,6 měsíců. Doba přežití je však jistě multifaktoriální proměnnou, jelikož ve skupině pacientů s metylací MGMT promotéru (06-methylaguanine–DNA methyltransferáza) byl střední OS signifikantně delší (33,4 měsíce) oproti skupině bez metylace (16,0 měsíců). SRS je pochopitelně pouze lokální terapeutická metoda, což dokumentuje fakt, že u pacientů s dobře dokumentovanou radiologickou progresí po SRS došlo u > ½ pacientů (53 %) k progresi mimo ozářenou oblast.
Obecně přínos reradiačních metod hodnotí Zwirner et al na souboru 51 pacientů s recidivou GBM. Za přínosnější považují režim hypofrakcionační či SRS (jednorázová dávka) oproti konvenčnímu normofrakcionačnímu [6]. Střední doba přežití po primární diagnóze byla 28,8 měsíců, po reiradiaci 9,8 měsíců. Malá podskupina (4 pacienti) ošetřená pomocí SRS dosáhla nejdelšího OS 36 měsíců, kdy všichni pacienti přežili > 2 roky po primární diagnóze. Pacienti léčení hypofrakcionačním režimem (n = 36) dosáhli středního OS 30,4 měsíce a pacienti léčení v normofrakcionačním režimu (n = 11) 22,3 měsíce. Dalším prognosticky příznivým faktorem byla menší velikost reiradiovaného nádoru do 6 cm3.
Výsledky pilotní studie využití primární SRS při léčbě GBM z roku 2002 publikovali Nwokedi et al. Tyto byly poměrně příznivé: ve skupině 64 pacientů bylo 33 léčeno konvenční radioterapií, ale u 31 dalších pacientů byl po jejím dokončení přidán boost pomocí gama nože na průměrné střední isodose 17,1 Gy [7]. Střední přežití u skupiny s rozšířenou léčbou bylo 25 měsíců oproti 13 měsícům u konvenční léčby. Na tuto práci navázala jediná randomizovaná multicentrická studie fáze III – RTOG 93-05 hodnotící celkově 203 pacientů, která však slibné klinické výsledky nepotvrdila [8]. Střední doba OS ve skupině SRS byla 13,5 měsíců oproti 13,6 měsícům u standardně léčených pacientů. Taktéž nebyly zaznamenány rozdíly ve 2 - a 3letém přežití. To dosahovalo 19 a 13 % ve skupině konvenčně léčených a 21 a 9 % ve skupině s radiochirurgickou adjuvancí. Argumentem pro SRS by mohlo být vyšší zastoupení radionekrózy u pacientů léčených SRS, kteří museli být v dalším průběhu operováni (59 pacientů). Ta vznikla u 7 z 28 (25 %) oproti konvenční léčbě, kdy byla u 3 z 31 (v 10 %). Zde je však nutné doplnit, že každý typ reradiace, nejen SRS, s sebou přináší větší riziko poradiačních komplikací. K negativnímu klinickému přínosu SRS v této studii lze ovšem namítnout, že v dané studijní skupině pacientů RTOG 93-05 je střední doba přežití oproti výše uvedeným pracím signifikantně kratší a rozsah chirurgické snahy o eliminaci nádorů není velký. Vstupní podmínkou byla pouze parciální resekce s reziduem ≤ 4 cm. Například ve skupině 86 pacientů léčených SRS je udáván průměrný maximální rozměr nádoru před operací 3,9 (1,5 – 7,5) cm a po operaci 3,0 (0,7 – 6,0) cm. V našem souboru připadá průměrně 2,1 operace na pacienta (1 – 4). Na druhou stranu silným argumentem proti efektu eskalace dávky a připomenutím složitosti bias je studie hodnotící vliv selekce pacientů na jejich přežití, kterou provedli Irish et al [9]. Po ukončení konvenční radioterapie byla střední doba přežití u pacientů potenciálně léčitelných pomocí SRS, která však nebyla aplikována, 23,4 měsíce oproti 8,6 měsícům u pacientů s větším zbytkovým nádorem. Taktéž je nutné brát v úvahu fakt, že doba přežití pacientů s GBM není uniformní, byť prognóza je velice špatná. Malá část pacientů (3 – 5 %) se dožívá > 36 měsíců, tito jsou označování jako „long-term survivors“. Jejich výskyt v malém souboru může ovlivnit jeho výsledky. Největší soubor těchto pacientů získaných z německé gliomové databáze byl publikován Krexem et al. Pacientů bylo 55, převážně léčených konvenčně – pouze u 3 pacientů (5,45 %) byla v průběhu léčby použita SRS [10]. Kromě mladšího věku, vstupně dobrého KPS a většího zastoupení MGMT hypermetylace (74 % z 36 vyšetřených) nebylo možno vysledovat faktory, které by pacienta predisponovaly k uspokojivějšímu výsledku léčby. Faktem vyplývajícím z článku však je, že možnost pokračování v léčbě byla u těchto dlouhodobě přeživších zajištěna i v případě recidivy, reoperace pro ni byla provedena u 25 pacientů (45 %), 12 pacientů (22 %) bylo operováno 3× a 4 pacienti (7 %) dokonce 4×. Tento přístup jistě nebyl veden léčebným nihilismem.
Poněkud odlišný koncept využití gama nože v léčbě GBM představuje tzv. LERS, který vytvořili a publikovali v roce 2016 Duma et al [11]. Výsledky 2-, 3-, 5-, 7 - a 10letého přežití byly 39, 26, 16, 10 a 4 %. Za povšimnutí stojí daleko větší ozařované objemy leading edge (LE) oproti práci ozařující pouze ložiska recidivy – střední objem 48,5 (2,5 – 2 200) cm3 oproti 7,0 (0,3 – 39,0) cm3. Větší ozařovaný objem je inverzní funkcí dávky záření v obou pracích. Koncept ozáření FLAIR hyperintenzity je vysvětlován ozářením objemu mozku, resp. jeho drah již infiltrovaného „migrujícími gliomovými buňkami“. Migrace gliomových buněk má jistě více faktorů, nicméně v poslední době se přikládá velký význam transkripčnímu faktoru repressor element 1-silencing transcription factor (REST) jakožto eventuálnímu cíli genové terapie. Další role hrají metalloproteináza 1 umožňující invazi do extracelulární matrix a vytvoření invadopodií. Buňky GBM pak mohou „putovat“ drahami, tenascin C dále zvyšuje kontraktilitu a adhezivitu buněk. Teoretickým podkladem LERS je, že dávka okolo 10 Gy snižuje motilitu buněk GBM. Naopak non-letální 2 Gy expozice ji naopak zvyšuje o 20 %, ozařování 60 Gy při normofrakcionaci po 2 Gy vede k lokální hypoxii, která může aktivovat migraci buněk GBM do okolí. Ozáření LE teoreticky vede k jizvení drah, zpomalení, resp. zástavě migrace buněk, tyto v tomto stavu podstupují sebedestrukci a následně dochází k jejich apoptóze, což v důsledku může vést i k autovakcinaci [11].
Závěr
Zařazení SRS pomocí gama nože do protokolu komplexní onkologické léčby u pacientů s onemocněním s tak špatnou prognózou jako je GBM je vhodné. Nutno připomenout, že EXBRT představuje společně s resekcí a chemoterapií standardní léčebný postup a SRS ji rozhodně nemůže primárně nahradit, může však rozšířit léčebné možnosti u recidiv, metodiku LERS nutno prozatím považovat za experimentální léčbu. Určitou nevýhodou je nutnost redukce dávky záření při SRS s ohledem na předchozí/ plánovanou EXBRT. Nepozorovali jsme však žádné život ohrožující vedlejší nežádoucí účinky SRS, dokumentovali jsme jeden případ radionekrózy (3 %).
U části našich pacientů můžeme hodnotit tuto léčbu jako přínosnou, v souboru se podařilo pomocí SRS po 3 měsících stabilizovat či zaléčit reziduální/ progredující ložisko ve 13 případech (37 %), po 6 měsících byl nádor stabilní či v regresi u 6 pacientů (18 %) ze souboru. Jednalo se o pacienty již zaléčené konvenční EXBRT. Lze tedy předpokládat, že kromě chemoterapie se jednalo o účinný efekt právě SRS.
Jednoznačně dlouhodobě dobrý klinický efekt trvající déle než 1 rok jsme zatím mohli pozorovat u 4 pacientů z 29 (13,8 %), a to vč. pacientky, u které SRS způsobila radionekrózu i u další, u níž docházelo k pomalé objemové progresi nádoru a která byla nakonec indikována k reresekci.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika UJEP
Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem o.z.
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Přijato k recenzi: 16. 2. 2018
Přijato do tisku: 19. 7. 2018
Zdroje
1. Mahajan A, McCutcheon IE, Suki D et al. Case-control study of stereotactic radiosurgery for recurrent glioblastoma multiforme. J Neurosurg 2005; 103(2): 210 – 217. doi: 10.3171/ jns.2005.103.2.0210.
2. Shrieve DC, Alexander E 3rd, Wen PY et al. Comparison of stereotactic radiosurgery and brachytherapy in the treatment of recurrent glioblastoma multiforme. Neurosurgery 1995; 36(2): 275 – 284.
3. Hsieh PC, Chandler JP, Bhangoo S et al. Adjuvant gamma knife stereotactic radiosurgery at the time of tumour progression potentially improves survival for patients with glioblastoma multiforme. Neurosurgery 2005; 57(4): 684 – 692.
4. Imber BS, Kanungo I, Braunstein S et al. Indications and efficacy of gamma knife stereotactic radiosurgery for recurrent glioblastoma: 2 decades of institutional experience. Neurosurgery 2017; 80(1): 129 – 139. doi: 10.1227/ NEU.0000000000001344.
5. Frischer JM, Marosi Ch, Woehrer A et al. Gamma knife radiosurgery in recurrent glioblastoma. Stereotact Funct Neurosurg 2016; 94(4): 265 – 272. doi: 10.1159/ 000 448924.
6. Zwirner K, Paulsen F., Schittenhelm J et al. Prognostic parameters and outcome after re-irradiation for progressive glioblastoma. Acta Neurol Scand 2017; 136(3): 239 – 245. doi: 10.1111/ ane.12719.
7. Nwokedi EC, DiBiase SJ, Jabbour S et al. Gamma knife stereotactic radiosurgery for patients with glioblastoma multiforme. Neurosurgery 2002; 50(1): 41 – 47.
8. Souhami L, Seiferheld W, Brachman D et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys 2004; 60(3): 853 – 860. doi: 10.1016/ j.ijrobp.2004.04.011.
9. Irish WD, MacDonald DR, Cairncross JG. Measuring bias in uncontrolled brain tumor trials – to randomize or not to randomize? Can J Neurol Sci 1997; 24(4): 307 – 312.
10. Krex D, Klink B, Hartman C et al. Long-term survival with glioblastoma multiforme. Brain 2007; 130(10): 2596 – 2606. doi: 10.1093/ brain/ awm204.
11. Duma CM, Kim BS, Chen PV et al. Upfront boost Gamma Knife „leading-edge“ radiosurgery to FLAIR MRI – defined tumor migration pathways in 174 patients with glioblastoma multiforme: a 15-year assessment of a novel therapy. J Neurosurg 2016; 125 (Suppl 1): 40 – 49. doi: 10.3171/ 2016.7.GKS161460.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2018 Číslo 5
-
Všechny články tohoto čísla
- Anestezie a nervosvalová onemocnění
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je INTRADUODENÁLNÍ LEVODOPA
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je APOMORFINOVÁ INFUZE
- Najlepší postup v terapii motoricky pokročilej Parkinsonovej nemoci je HLBOKÁ MOZGOVÁ STIMULÁCIA
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je intraduodenální levodopa, apomorfi nová infuze nebo DBS?
- Cervikální vertigo – fikce či realita?
-
Cervikální vertigo – fikce či realita?
Komentář k článku Z. Kadaňky Jr. et al - Péče o pacienty s dysfagií po cévní mozkové příhodě v České republice
- Matematické modelování hemodynamiky mozkových aneuryzmat a možný přínos v klinické praxi z pohledu neurochirurga
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Léčba recidivy či rezidua multiformního glioblastomu pomocí stereotaktické radiochirurgie gama nožem – společně hodnocený soubor dvou neurochirurgických pracovišť
- Tichý akútny a subakútny mozgový infarkt u pacientov pred koronárnou intervenciou
- Vztah mezi epidemiologií a subjektivním vnímáním bolesti u pacientů se syndromem karpálního tunelu
- Umístění bifurkace bazilární tepny ve vztahu k dorsu sellae
- Validace dotazníku pro pacienty s myotonií – česká verze Myotonia Behaviour Scale
- Zrozumiteľnosť reči a klinické parametre u pacientov s Parkinsonovou chorobou
- První dokumentovaný případ japonské encefalitidy importované do České republiky
- Spinální schwannom v oblasti hrudní páteře s masivním intratumorálním krvácením
- Časná komplikace ošetření disekujícího intrakraniálního aneuryzmatu ve vertebrobazilárním povodí flow-diverterem
- Svalová dystopie ve Fallopiově kanálu
- Harvey Cushing jako kandidát Nobelovy ceny
- Stanovisko Výboru Cerebrovaskulární sekce České neurologické společnosti ČLS JEP k dlouhodobému holterovskému EKG monitoringu u pacientů s ischemickou cévní mozkovou příhodou
- Analýza dat v neurologii LXXI.<br>Pearsonův korelační koeficient
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Cervikální vertigo – fikce či realita?
- Anestezie a nervosvalová onemocnění
