Neuropatická komponenta bolesti u pacientů s myotonickou dystrofií 2. typu – pilotní studie
Neuropathic pain component in patients with myotonic dystrophy type 2 – a pilot study
Aim: Patients with myotonic dystrophy (MD) may suffer from variable types of pain and some descriptors suggest the involvement of a possible neuropathic pain component in MD patients. The aim of the study was to evaluate the occurrence of neuropathic pain descriptors and sensory abnormalities in patients with myotonic dystrophy type 2 (MD2) and to disclose the presence of some relevant psychological factors in chronic pain conditions.
Patients and methods: A group of 23 patients with MD2 suffering from chronic pain and a group of 24 age - and gender-matched healthy controls were examined using the PainDETECT questionnaire and the Neuropathic Pain Symptom Inventory questionnaire (NPSI), a comprehensive protocol of quantitative sensory testing (QST) and a battery of self-reported psychological tests.
Results: Based on the PainDETECT questionnaire, the presence of a neuropathic component of pain was evaluated as possible or probable in more than half of the patients. According to the NPSI questionnaire, the most frequently described spontaneous pain in patients with MD2 was squeezing. Very common are brief pain attacks of stabbing pain, and two thirds of patients also described abnormal sensations (pins and needles and/or tingling) in the painful area. QST in lower legs showed significantly more frequent hypoesthesia for cold and hyperalgesia for mechanical pain stimuli and also higher incidence of paradoxical heat sensation. Patients with MD2 also showed significantly more frequent depression and pain catastrophizing.
Conclusion: The pain descriptors evaluated by PainDETECT and NPSI questionnaires, and sensory profile assessed by the QST protocol performed in this pilot study support the hypothesis that pain in MD2 patients probably has a neuropathic component.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
强直性肌营养不良2型患者神经性疼痛成分的初步研究
目的:
强直性肌营养不良(MD)患者可能会遭受不同类型的疼痛,一些描述符表明,MD患者可能涉及一种神经性疼痛成分。本研究旨在评估2型强直性肌营养不良(MD2)患者神经性疼痛描述符和感觉异常的发生情况,并揭示慢性疼痛状态下相关心理因素的存在。
患者和方法:
一群23 MD2患者遭受慢性疼痛和一群24岁——准确性健康对照检查库存使用PainDETECT问卷和神经性疼痛症状问卷(NPSI),一个全面的协议的定量感觉测试(QST)和自我心理测试的电池。
结果:
根据疼痛检测问卷,一半以上的患者可能存在或可能存在疼痛的神经病理性成分。根据NPSI问卷调查,描述MD2患者自发性疼痛最常见的是挤压。很常见的是刺痛的短暂疼痛发作,三分之二的患者还描述了疼痛区域的异常感觉(针刺和/或刺痛)。下肢QST表现为明显的冷觉过敏和机械痛刺激痛觉过敏,以及较高的反常热感觉发生率。MD2患者也明显表现出更频繁的抑郁和疼痛恶化。
结论:
通过疼痛检测和NPSI问卷评估的疼痛描述符,以及在本试点研究中执行的QST方案评估的感觉特征,支持MD2患者的疼痛可能有神经病理性成分的假设。
关键词:
强直性肌营养不良-疼痛-神经性疼痛-描述符-心理学
Keywords:
myotonic dystrophy – Pain – Neuropathic pain – descriptors – Psychology
Autoři:
O. Parmová 1; E. Vlčková 1,2; J. Bednařík 1,2; S. Voháňka 1,2
Působiště autorů:
Neurologická klinika LF MU a FN Brno
1; CEITEC – Středoevropský technologický institut, Brno
2
Vyšlo v časopise:
Cesk Slov Neurol N 2019; 82(3): 322-332
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn2019322
Souhrn
Cíl: Bolest u myotonické dystrofie (MD) může mít variabilní charakter a některé deskriptory poukazují na možný podíl neuropatické komponenty bolesti u pacientů s MD. Cílem práce bylo zhodnocení výskytu deskriptorů neuropatické bolesti a senzitivních abnormit u pacientů s MD 2. typu (MD2) a posouzení některých psychologických faktorů významných v rozvoji chronické bolesti.
Soubor a metodika: Skupina 23 pacientů s chronickou bolestí a MD2 a skupina 24 zdravých dobrovolníků obdobného věku a pohlaví byly vyšetřeny pomocí dotazníků PainDETECT a Neuropathic Pain Symptom Inventory (NPSI), komplexního protokolu kvantitativního testování senzitivity (quantitative sensory testing; QST) a baterie sebehodnotících psychologických testů.
Výsledky: Dotazník PainDETECT poukázal na možnou či pravděpodobnou přítomnost neuropatické komponenty bolesti u více než poloviny pacientů. Podle dotazníku NPSI je spontánní bolest u pacientů s MD2 nejčastěji svíravá. Velmi časté jsou krátké záchvaty bodavé bolesti a téměř dvě třetiny pacientů vnímají brnění či mravenčení. QST prokázalo častý výskyt abnormit termického a algického čití, a to zejména na dolních končetinách. Pacienti s MD2 vykazovali také statisticky významně vyšší míru deprese a katastrofizace bolesti.
Závěr: Deskriptory bolesti zachycené v rámci dotazníků PainDETECT a NPSI a senzitivní profil stanovený pomocí QST protokolu podporují v provedeném pilotním projektu hypotézu, že bolest u MD2 má pravděpodobně také neuropatickou komponentu.
Klíčová slova:
myotonická dystrofie – bolest – neuropatická bolest – deskriptory – psychologie
Úvod
Chronická bolest je celosvětově závažný zdravotní problém. Studie provedené v různých zemích dokazují, že chronickou bolestí trpí 10–30 % dospělé populace [1–3]. U nervosvalových chorob se chronická bolest vyskytuje dokonce u 60–80 % pacientů [4–6]. Intenzita a frekvence bolesti u progresivních neuromuskulárních chorob je podle provedených studií významně vyšší než v běžné populaci [7].
Myotonická dystrofie (MD) je nejčastější svalovou dystrofií v dospělém věku a druhou nejčastější svalovou dystrofií obecně. Jde o autozomálně dominantní multisystémové onemocnění s progresivní degenerací kosterních svalů. Hlavními projevy jsou progredující svalová slabost, myotonie a charakteristická multiorgánová postižení jako katarakta projevující se v mladším věku, poruchy srdečního rytmu a kardiomyopatie, kognitivní deficit, endokrinní poruchy, postižení gastrointestinálního traktu, únava, ospalost aj. Rozeznáváme dvě základní formy choroby s odlišným genetickým podkladem, a to MD typ 1 a MD typ 2 (MD2). Bolest u MD je častým a závažným příznakem choroby a její výskyt se pohybuje mezi 50–75 % [6,8–10]. Etiologie bolesti u MD není dosud spolehlivě objasněna a je pravděpodobně multifaktoriální. Jako jeden z multisystémových projevů u MD je popisováno i postižení periferních
nervů [11,12].
Cílem této pilotní studie bylo zhodnotit možný podíl neuropatické komponenty bolesti u pacientů s MD2 prostřednictvím posouzení charakteristik bolesti a senzitivních abnormit (jejichž hodnocení patří k nejvýznamnějším a nejčastěji užívaným diagnostickým metodám ve výzkumu neuropatické bolesti) a posouzení některých psychologických charakteristik těchto pacientů jako potenciálně významných faktorů v rozvoji bolesti.
Soubor a metodika
V rámci prezentované studie jsme vyšetřili 23 pacientů s MD2 (potvrzenou molekulárně-geneticky v Centru molekulární biologie a genové terapie FN Brno) a chronickou bolestí (20 žen; průměrný věk 53,5 ± 11,0 let, rozmezí 33–70 let) a skupinu 24 zdravých dobrovolníků obdobného věku a pohlaví (20 žen; průměrný věk 51,9 ± 8,9 let, rozmezí 36–68 let). Všichni vyšetření pacienti s MD2 byli chodící, z toho 22 pacientů (95,7 %) mělo známky svalové slabosti, která byla typicky lokalizována v kořenových svalech horních (HKK) a dolních (DKK) končetin, šíjových svalech nebo akrálních svalech DKK. Při hodnocení svalové síly pomocí Medical Research Council sum score (identická se svalovým testem dle Jandy) byla ve vyšetřovaném souboru průměrná hodnota skóre 163,7 ± 4,9 (maximální dosažitelné skóre při plné svalové síle ve všech hodnocených svalových skupinách dosahuje hodnoty 170 [13]), což odpovídá lehkému stupni svalového postižení, které je charakteristické pro MD2. Průměrný věk v době prvních projevů choroby byl 38,3 ± 11,9 let (rozmezí 15–65 let). Všichni vyšetření pacienti udávali nepříjemné bolestivé pocity končetin a trupu trvající déle než 3 měsíce. Detailní popis distribuce a intenzity bolesti je součástí výsledkové části práce. Osmnáct vyšetřených pacientů (78,3 %) mělo klinické projevy myotonie (poruchy svalové dekontrakce). V rámci standardního klinického vyšetření nevykazovali pacienti změny myotatických reflexů ani změny polohocitu, pohybocitu či vibrační nebo taktilní citlivosti jako známky postižení silných nervových vláken. Vylučujícím kritériem pro zařazení do souboru byly diabetes mellitus či porucha glukózové tolerance a také anamnestický výskyt jakýchkoli jiných rizikových faktorů polyneuropatií kromě mírné hypotyreózy, která byla přítomna u 6 z 23 pacientů (26,1 %) a byla ve všech případech medikamentózně kompenzována. Z ostatních sledovaných systémových příznaků MD byla přítomna katarakta (17/ 23 pacientů), poruchy srdečního rytmu (6/ 23 pacientů), postižení reprodukčních orgánů či infertilita (3/ 23 pacientů) a hyperhidróza (11/ 23 pacientů). Většina vyšetřených pacientů užívala dlouhodobě analgetika, a to nejčastěji nesteroidní antirevmatika (52,2 %), méně často tramadol (17,4 %) nebo kombinaci obojího (4,3 %). Část pacientů (26,1 %) navzdory popisované intenzitě bolestí žádná analgetika pravidelně neužívala. Současně žádný z pacientů neužíval antineuralgickou terapii, protože bolest u MD není standardně vnímána jako bolest neuropatická. Čtyřicet osm hodin před provedením studie neužili pacienti analgetika. V souboru zdravých dobrovolníků neměl ani jeden ze zařazených jedinců bolesti končetin či trupu ani známky polyneuropatie, svalové slabosti nebo myotonie.
Pacienti i dobrovolníci vyplnili dotazník PainDETECT a validovanou českou verzi dotazníku Neuropathic Pain Symptom Inventory (NPSI) [14–16]. Dotazník PainDETECT je primárně určen pro diagnostiku neuropatické bolesti a umožnuje stanovení míry pravděpodobnosti výskytu neuropatické komponenty bolesti u daného pacienta. Zohledňuje výskyt typických symptomů neuropatické bolesti, jejich intenzitu, průběh obtíží a jejich vyzařování do dalších částí těla. Při dosažení skóre 0–12 bodů je výskyt neuropatické komponenty nepravděpodobný. Skóre 13–18 bodů představuje nejednoznačný výsledek, kdy je přítomnost neuropatické komponenty bolesti možná. Při hodnotách skóre 19 a více je výskyt neuropatické komponenty bolesti u daného pacienta vysoce pravděpodobný (> 90 %). Dotazník NPSI je zaměřen na popis charakteru bolesti vyšetřovaného v posledních 24 h. Intenzita bolesti je hodnocena pomoci škály
Numeric Rating Scale (NRS) v rozsahu 0–10 bodů, kde „0“ představuje „žádnou bolest“ a „10“ znamená „nejhorší představitelnou
bolest“.
Dále jsme u pacientů a dobrovolníků podrobně vyšetřili senzitivní profil s použitím české verze komplexního protokolu kvantitativního testování senzitivity (Quantitative Sensory Testing; QST) zavedeného německou pracovní skupinou pro výzkum neuropatické bolesti (Der Deutsche Forschungsverbund Neuropathischer Schmerz [DFNS], The German Research Network on Neuropathic Pain) [17,18]. QST je standardizovaná metoda k posouzení somatosenzitivních funkcí kvantifikací percepce široké škály senzitivních a algických modalit [19]. Protokol QST reflektuje funkci silných (A-beta) i tenkých nervových vláken (A-delta i C) a patří mezi klíčové metody v diagnostice neuropatické bolesti. Vyšetření jsme provedli na HKK a DKK, a to vždy jednostranně na končetině, kde pacienti udávali větší bolesti. Vyhodnotili jsme senzitivní prahy (tj. nejnižší intenzitu dané modality, jež u vyšetřovaného subjektu vyvolá percepci podnětu) a prahy algické (tj. nejnižší intenzitu dané modality, která u vyšetřovaného vede k vyvolání bolestivého vjemu). U všech pacientů i dobrovolníků jsme v rámci protokolu QST vyšetřili senzitivní práh pro teplo (warm detection threshold), chlad (cold detection threshold) a také tzv. neutrální teplotní rozsah (thermal sensory limen), tedy teplotní rozmezí, v němž pacient vnímá teplotu jako neutrální. Hodnoceny byly dále vibrační čití (vibration detection threshold), senzitivní práh pro mechanickou kožní citlivost (mechanical detection threshold), algický práh pro ostrou mechanicky vyvolanou bolest (mechanical pain threshold) a hlubokou tlakovou bolest (pressure pain threshold; PPT), senzitivita pro ostrou mechanicky vyvolanou bolest (mechanical pain sensitivity), časová sumace ostrých mechanicky vyvolaných bolestivých podnětů hodnocená pomocí tzv. wind-up ratio (WUR), termoalgický práh pro teplo (heat pain threshold) a chlad (cold pain threshold), výskyt tzv. paradoxního vnímání chladu jako tepla (paradoxical heat sensation) a mechanická dynamická alodynie.
Stanovení těchto modalit umožňuje vytvořit tzv. senzitivní profil poskytující komplexní přehled o senzitivní percepci u daného pacienta.
Všichni pacienti a zdravé kontroly také vyplnili baterii sebehodnotících psychologických testů. Ke zhodnocení příznaků deprese byl použit dotazník Beck Depression Inventory (BDI) [20]. Ke zhodnocení katastrofizace bolesti byla použita škála Pain Catastrophizing Scale (PCS) [21].
Statistická analýza
Statistické výpočty byly provedeny pomocí softwaru Microsoft Excel (Microsoft Corporation, Redmont, WA, USA) a programu Statistica 12 (StatSoft s.r.o., Praha, Česká republika). Data získaná z dotazníků PainDETECT, NPSI, BDI a PCS byla normálně distribuována. Pro jejich srovnání mezi pacienty a kontrolami byl použit nepárový t-test, ke zviditelnění rozložení hodnot byly použity průměry a směrodatné odchylky. Data získaná z měřených charakteristik QST nevykazovala normální distribuci, pro srovnání jednotlivých parametrů QST mezi kontrolní skupinou a skupinou pacientů byl použit Mann-Whitneyův U Test a ke zviditelnění rozložení hodnot byly použity mediány a percentily. Vedle absolutních hodnot prahů vyjádřených v původních měrných jednotkách (°C, kPa, mN apod.) byly jednotlivé parametry QST vyjádřeny také formou tzv. Z-skóre, tedy počtu směrodatných odchylek od průměrné hodnoty prahu v příslušné věkové kategorii publikovaného normativního souboru (obr. 1,2). Kladné hodnoty Z-skóre přitom představují zvýšenou citlivost pro danou modalitu, záporné hodnoty naopak citlivost sníženou.
Fig. 1. Quantitative sensory testing of the upper limbs: Z-score.
The data are presented as a median (point) and a non-outlier range (whisker). The arrow
shows parameters with statistically significant differences between the control group
and MD2 patients (indicating a statistically significant value).
CDT – cold detection threshold; CPT – cold pain threshold; HPT – heat pain threshold; MD2 –
myotonic dystrophy type 2; MDT – mechanical detection threshold; MPS – mechanical pain
sensitivity; MPT – mechanical pain threshold; PPT – pressure pain threshold; TSL – thermal
sensory limen; VDT – vibration detection threshold; WDT – warm detection threshold;
WUR – wind-up ratio
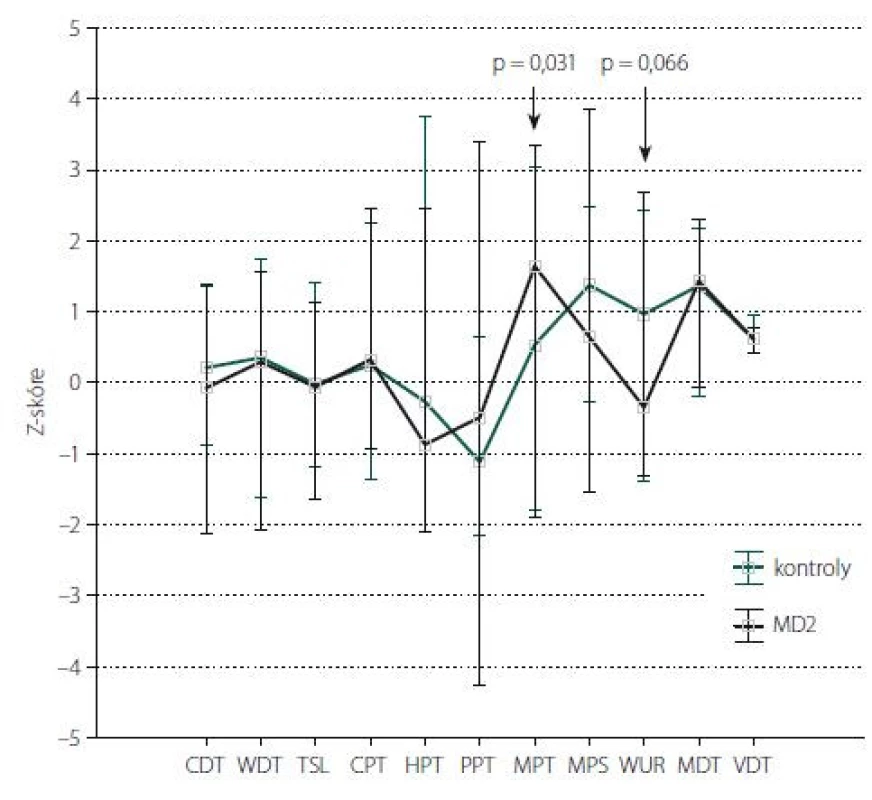
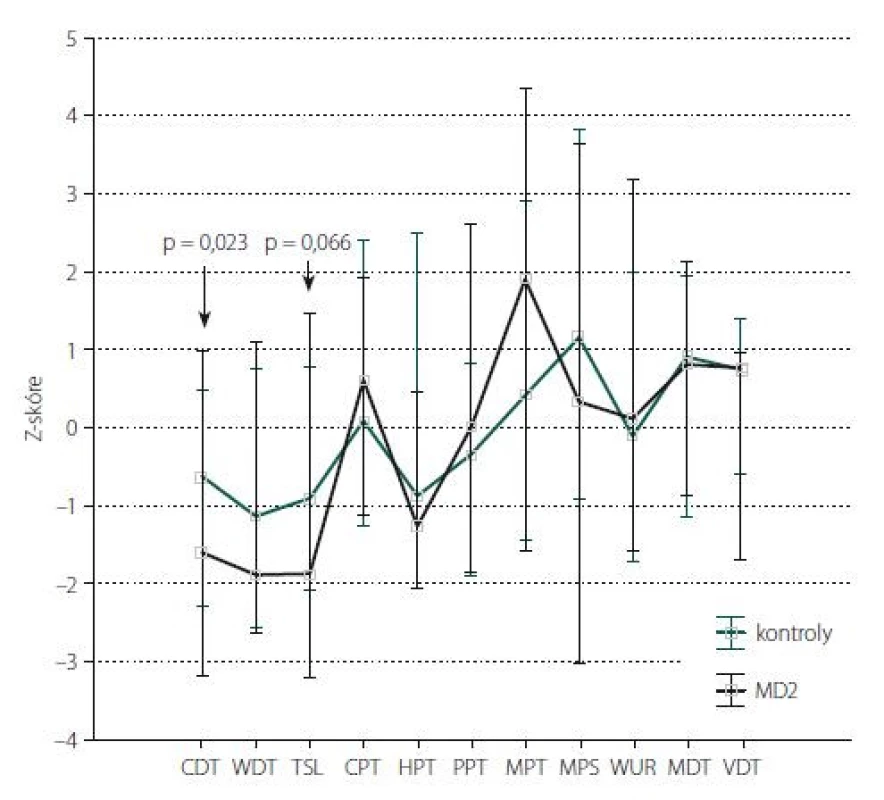
Fig. 2. Quantitative sensory testing of the lower limbs: Z-score.
The data are presented as a median (point) and a non-outlier range (whisker). The arrow
shows parameters with statistically significant differences between the control group
and MD2 patients (indicating a statistically significant value).
CDT – cold detection threshold; CPT – cold pain threshold; HPT – heat pain threshold; MD2 –
myotonic dystrophy type 2; MDT – mechanical detection threshold; MPS – mechanical pain
sensitivity; MPT – mechanical pain threshold; PPT – pressure pain threshold; TSL – thermal
sensory limen; VDT – vibration detection threshold; WDT – warm detection threshold;
WUR – wind-up ratio
Kategoriální data jsou znázorněna pomocí absolutních (relativních) četností. Pro srovnání kategoriálních dat (frekvence výskytu abnormit typu ano/ ne) mezi skupinou zdravých kontrol a skupinou pacientů byl použit chí-kvadrát test. Pro korelaci mezi celkovým počtem QST abnormit a sumárním NPSI skóre byl použit Pearsonův korelační koeficient.
Výsledky
Charakteristika bolesti
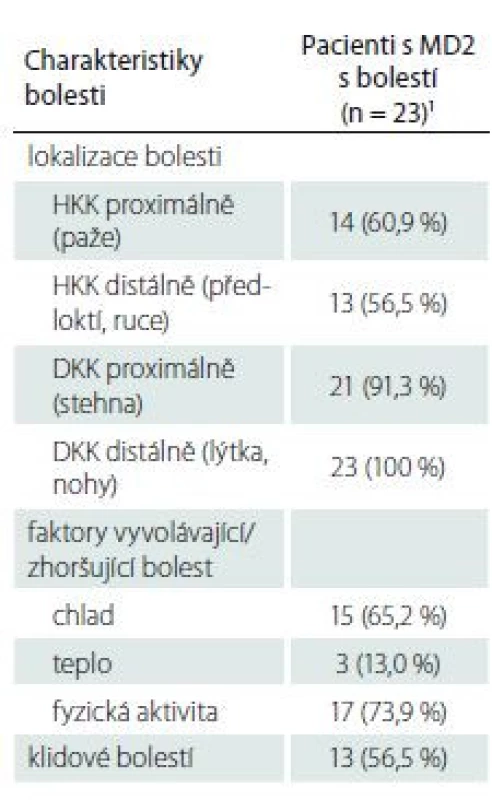
Všichni pacienti udávali výskyt bolestí na DKK, a to distálně a ve více než 90 % případů současně proximálně v oblasti stehen. Téměř dvě třetiny pacientů měly bolesti i na HKK, a to častěji proximálně v oblasti paží (tab. 1). Většinou se jednalo o bolest symetrickou. Bolest byla nejčastěji vyvolána fyzickou aktivitou a/ nebo chladem. Klidové bolesti vykazovala více než polovina pacientů. Průměrná intenzita bolesti udávaná pacienty při základním anamnestickém vyšetření byla dle škály NRS 5,2 ± 1,3.
Vyhodnocení dotazníku PainDETECT
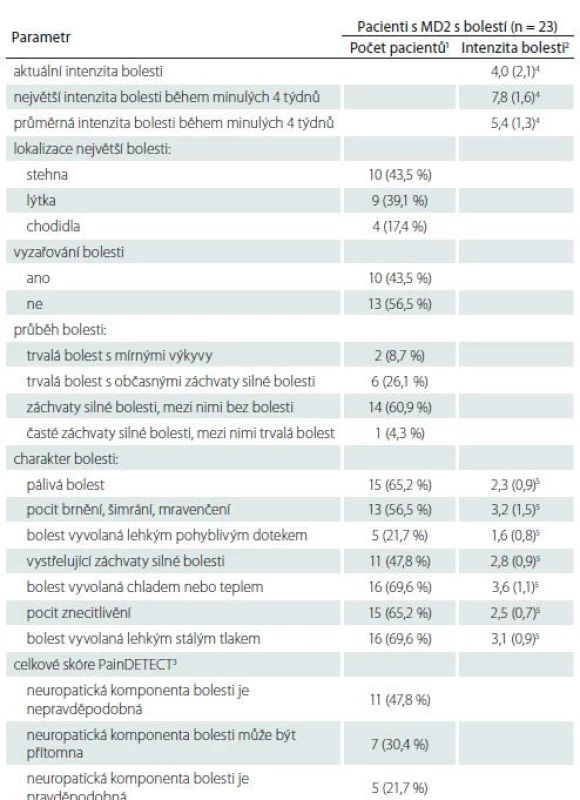
Dotazník PainDETECT prokázal možnou nebo pravděpodobnou přítomnost neuropatické komponenty bolesti u více než poloviny pacientů s MD2 (tab. 2). Nejintenzivnější bolesti byly lokalizovány ve stehnech a lýtkách, méně pak v chodidlech. Průměrná intenzita bolesti dle škály NRS tohoto dotazníku dosahovala hodnot 5,4 ± 1,3 (tab. 2).
2 průměry (směrodatné odchylky) nenulových hodnot daného parametru
3 vypočteno z otázek zaměřených na vyzařování bolesti, její průběh a charakter (v souladu s originální verzí dotazníku dle Freynhagena [16])
4 hodnoceno pomocí škály NRS v rozsahu 0–10 bodů
5 hodnoceno pomocí 6bodové verbální škály bolesti, každému verbálnímu deskriptoru intenzity je přidělena určitá číselná hodnota (vůbec ne = 0; takřka vůbec = 1; málo = 2; středně = 3; silně = 4; velmi silně = 5)
MD2 – myotonická dystrofie 2. typu
Vyhodnocení dotazníku NPSI
Dotazník NPSI, vytvořený primárně za účelem detailního popisu charakteru bolesti, prokázal alespoň jeden z deskriptorů typických pro neuropatickou bolest s jedinou výjimkou u všech vyšetřovaných pacientů s MD2. Většina pacientů popisovala bolesti spontánní chronické (87 % pacientů) a současně krátké záchvatovité bolesti (82,6 % pacientů). Spontánní bolest byla nejčastěji svíravá. Méně častá byla bolest vyvolaná, i když i tu uvádělo až 65,2 % pacientů. Nejčastěji byly bolesti u pacientů vyvolané či zhoršené tlakem (43,5 %) nebo kontaktem s chladem či teplem (39,1 %). Abnormální pocity jako brnění a mravenčení uvádělo 78,3 % pacientů. Průměrná intenzita udávané bolesti v jednotlivých položkách byla střední (NRS 5,2 až 6,4) (tab. 3). Jedno z derivovaných skóre české verze dotazníku (tzv. skóre NPSIcz - D vytvořené autory na podkladě diskriminační analýzy [15]) umožňuje i diskriminaci pacientů s neuropatickou a nociceptivní bolestí (i když k tomuto účelu nebyl dotazník primárně vytvořen). V našem souboru byla při použití tohoto skóre bolest klasifikována jako neuropatická u 22 pacientů (95,7 %) a nociceptivní u 1 pacienta (4,3 %), a resp. jako periferní neuropatická u 20 pacientů (87,0 %) a spontánní nociceptivní u 3 pacientů (13 %).
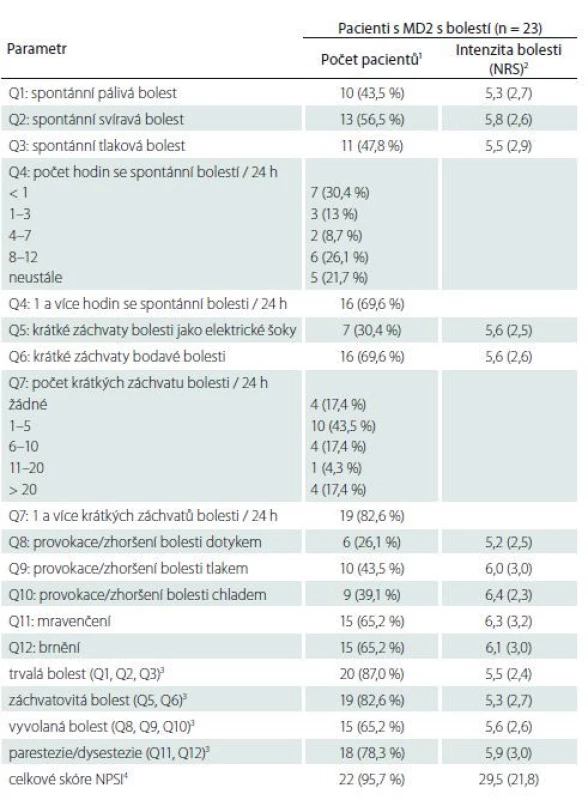
2 vypočteno jako průměry (směrodatné odchylky) z nenulových hodnot daného parametru
3 dílčí škály NPSI jsou vypočtené jako součet relevantních položek (uvedených v závorce)
4 celkové skóre NPSI je vypočteno jako součet položek Q1–Q3, Q5–Q6 a Q8–Q12 a dosahuje hodnot v rozmezí 0–100
MD2 – myotonická dystrofi e 2. typu; NPSI – Neuropathic Pain Symptom Inventory; NRS – Numeric
Rating Scale
Vyhodnocení protokolu QST
Kvantitativní testování senzitivity prokázalo na HKK u pacientů s MD2 oproti zdravým kontrolám signifikantně častější hyperalgezii pro mechanické algické podněty a sníženou časovou sumaci mechanických algických podnětů (obr. 1, tab. 4). Rozdíl druhého ze jmenovaných parametrů byl však pravděpodobně podmíněn spíše abnormálním zvýšením jeho hodnot u některých jedinců v souboru zdravých kontrol. Na DKK nebyly rozdíly časové sumace bolestivých podnětů mezi oběma skupinami významně odlišné, u pacientů s MD2 jsme zde však zachytili významně častější hypestézii pro chlad (a to zejména při relativním vyjádření hodnot ve vztahu k věkově stratifikovaným datům a hraničně i při hodnocení absolutních hodnot prahů) (obr. 2, tab. 5). Významně častější byly u pacientů s MD2 také hyperalgezie pro mechanické algické podněty a výskyt paradoxního vnímání chladných podnětů jako teplých či horkých (obr. 2, tab. 5). Při vyjádření individuálních hodnot jednotlivých parametrů ve vztahu k věkově stratifikovaným normativním datům (formou tzv. Z-skóre) byla na DKK patrná také signifikantní hypestezie pro teplo: abnormální termický práh pro teplo byl prokázán u 11 z 23 vyšetřených pacientů s MD2. Rozdíly absolutních hodnoty termických prahů pro teplo mezi pacienty s MD2 a zdravými kontrolami však nedosáhly statistické významnosti, pravděpodobně z důvodu určitých malých rozdílů ve věkové distribuci pacientů mezi oběma skupinami a menšího počtu jedinců v obou skupinách (tab. 5). Dále byl patrný trend k širšímu teplotnímu rozsahu, v němž pacienti vnímali tepelně neutrální vjem. Ani rozdíly tohoto parametru mezi zdravými kontrolami a pacienty s MD2 však nedosáhly statistické významnosti (obr. 2, tab. 5).
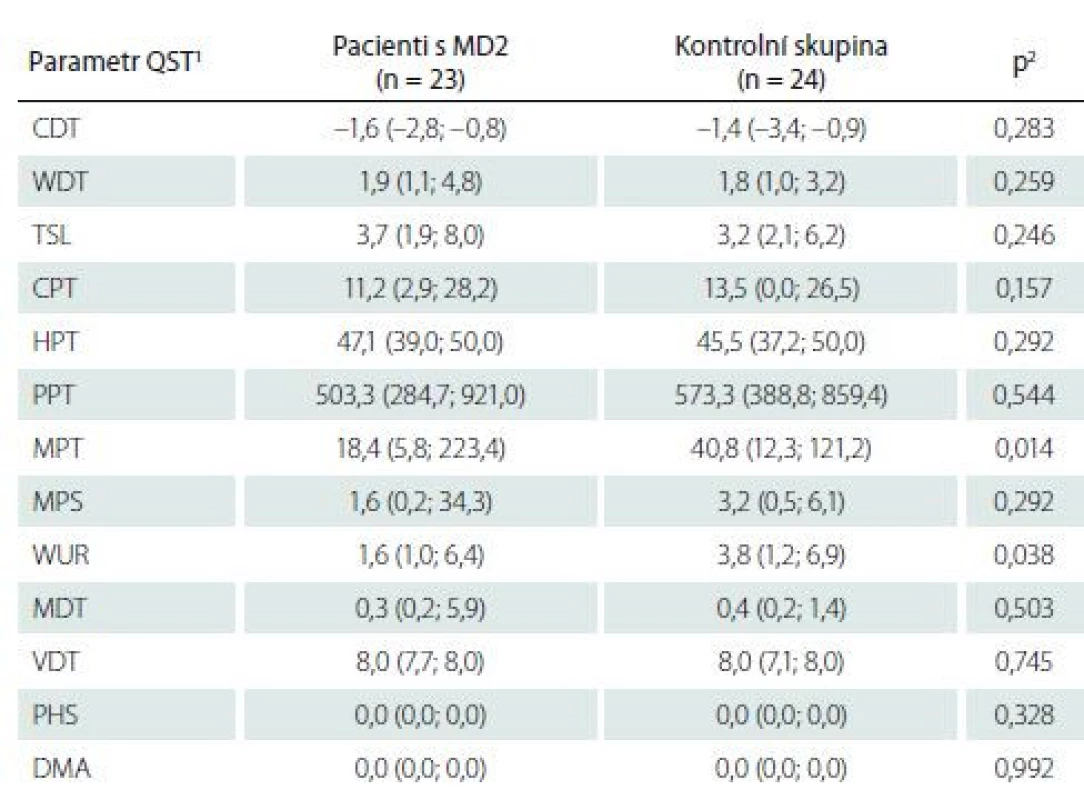
2 srovnání hodnot jednotlivých parametrů QST mezi pacienty s MD2 a zdravými dobrovolníky bylo provedeno pomocí Mann-Whitneyova U testu
CDT – senzitivní práh pro chlad; CPT – termoalgický práh pro chlad; DMA – dynamická mechanická
alodynie; HPT – termoalgický práh pro teplo; MD2 – myotonická dystrofie 2. typu; MDT
– senzitivní práh pro mechanickou kožní citlivost; MPS – senzitivita pro ostrou, mechanicky
vyvolanou bolest; MPT – algický práh pro ostrou, mechanicky vyvolanou bolest; PHS – paradoxní
vnímání chladných podnětů jako horkých; PPT – algický práh pro hlubokou tlakovou
bolest; QST – kvantitativní testování senzitivity; TSL – teplotní rozsah, vnímaný jako neutrální;
VDT – senzitivní práh pro vibrační čití; WDT – senzitivní práh pro teplo; WUR – časová sumace
ostrých mechanicky vyvolaných bolestivých podnětů
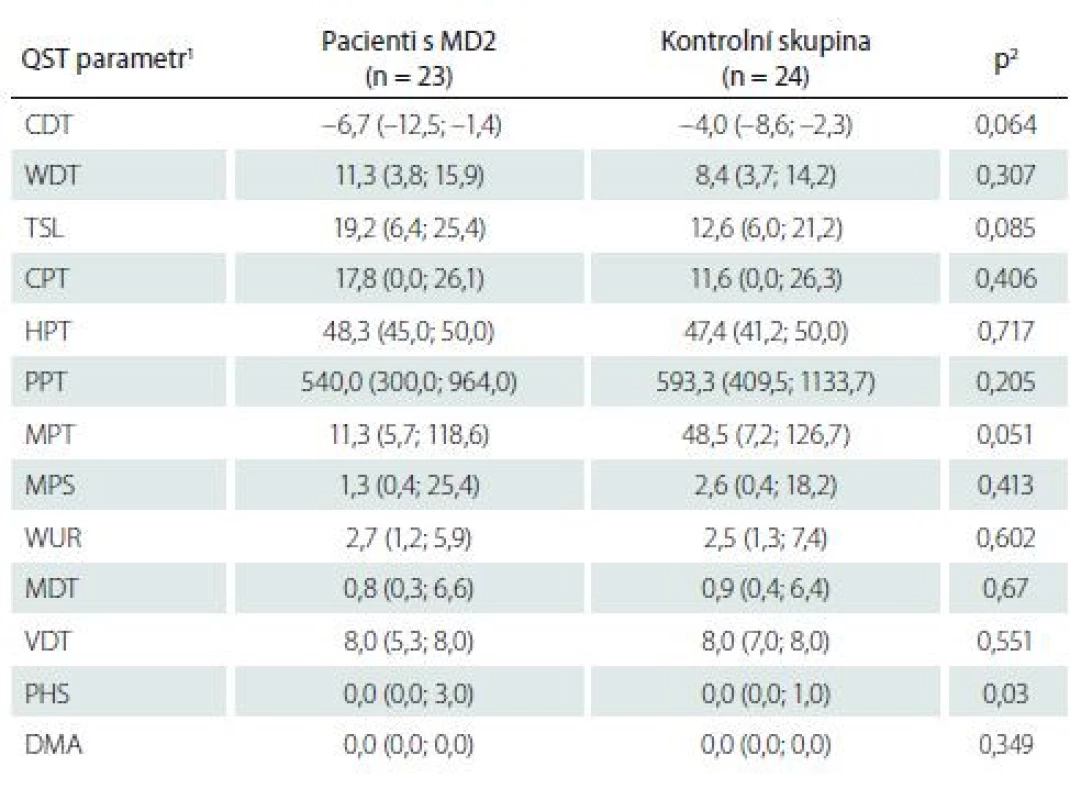
2 srovnání hodnot jednotlivých QST parametrů mezi pacienty s MD2 a zdravými dobrovolníky
bylo provedeno pomocí Mann-Whitneyova U testu
CDT – senzitivní práh pro chlad; CPT – termoalgický práh pro chlad; DMA – dynamická mechanická
alodynie; HPT – termoalgický práh pro teplo; MD2 – myotonická dystrofie 2. typu; MDT
– senzitivní práh pro mechanickou kožní citlivost; MPS – senzitivita pro ostrou, mechanicky
vyvolanou bolest; MPT – algický práh pro ostrou, mechanicky vyvolanou bolest; PHS – paradoxní
vnímání chladných podnětů jako horkých; PPT – algický práh pro hlubokou tlakovou
bolest; QST – kvantitativní testování senzitivity; TSL – teplotní rozsah, vnímaný jako neutrální;
VDT – senzitivní práh pro vibrační čití; WDT – senzitivní práh pro teplo; WUR – časová sumace
ostrých mechanicky vyvolaných bolestivých podnětů
Celkový počet abnormit QST na HKK nebyl u pacientů s MD2 významně odlišný ve srovnání s kontrolní skupinou (p = 0,76). Tento rozdíl však byl velmi vysoce významný na DKK, kde celkový počet abnormit QST u pacientů s MD2 více než dvojnásobně přesáhl počet abnormit zachycených ve skupině zdravých kontrol (p < 0,001, data detailně neuvedena).
Vyhodnocení psychologických dotazníků
V sebehodnotících psychologických dotaznících vykazovali pacienti s bolesti a MD2 statisticky významně vyšší míru deprese a katastrofizace bolesti (tab. 6).

2 srovnání jednotlivých dotazníků mezi pacienty s MD2 a zdravými kontrolami, provedené pomocí
nepárového t-testu
BDI – Beck Depression Inventory; MD2 – myotonická dystrofie 2. typu; PCS – Pain Catastrophizing
Scale
Diskuze
Bolest u MD je poměrně častým klinickým příznakem, mechanizmus jejího vzniku však není přesně znám a je pravděpodobně multifaktoriální. Není také jasné, proč u některých pacientů s MD dojde k rozvoji bolesti a u jiných ne nebo proč bolest často vzniká ve stadiu onemocnění, kdy ještě nedošlo ke klinicky manifestnímu postižení svalového systému [22].
Jednou z možných hypotéz vzniku bolesti u MD může být například abnormální zátěž pohybového aparátu v důsledku svalové dysbalance při oslabení některých svalových skupin nebo při myotonii hlubokých svalů, kdy dlouhodobě zvýšený tonus hlubokého svalstva vyčerpává svaly této skupiny i jejich antagonisty [6]. Dlouhodobá kontrakce svalu při myotonii může vést i k hypoperfuzi, vyplavení laktátu, poklesu hodnoty pH a uvolnění dalších látek, které mohou provokovat bolest, jako jsou bradykinin, adenozintrifosfát a ionty vodíku [20]. Na vzniku bolesti by se tak dle této hypotézy mohly podílet také změny, které přímo souvisejí s patofyziologickým řetězcem této choroby v rámci její multisystémové manifestace, kdy akumulace expandované transkribované ribonukleové kyseliny (RNA) poškozuje buněčné procesy a ovlivňuje sestřih RNA dalších desítek genů [24]. Důsledkem tohoto patofyziologického řetězce může být i zvýšení nocicepce. Všechny zmiňované mechanizmy jsou však spíše hypotetické a jednoznačný průkaz jejich významu v patofyziologii bolesti u MD není dosud k dispozici.
Charakter bolestí u pacientů s MD může být velmi variabilní. Při použití jednoho z nejčastěji užívaných dotazníků zaměřených na deskriptory bolesti (McGill Pain Questionnaire) udávali pacienti s MD v jedné z publikovaných studií bolest trhavou (škubavou), tupou, bodavou, tíživou, křečovitou, vyčerpávající nebo bolest charakteru nepříjemných pocitů ve svalech, jako je napětí, citlivost [10]. Některé ze zmíněných deskriptorů ukazují na možnou neuropatickou komponentu bolesti u pacientů s MD. Možnost neuropatické komponenty bolesti u pacientů s MD podporuje i vyhodnocení výsledků dotazníků PainDETECT a NPSI v naší studii. Dotazník PainDETECT, vytvořený cíleně za účelem identifikace neuropatické komponenty smíšených bolestí, prokázal při použití cut-off hodnot doporučených autory dotazníku neuropatickou komponentu bolesti jako možnou či pravděpodobnou u více než poloviny našeho souboru pacientů s MD2. Dotazník přitom dle recentních studií vykazuje u pacientů se smíšenou (např. radikulární) bolestí spíše nižší senzitivitu a řada autorů doporučuje snížení hodnoty cut-off. V nedávno publikované studii zaměřené na pacienty s radikulární bolestí vykazoval dotazník nejlepší diagnostickou validitu při cut-off hodnotě 11, ani pak však senzitivita nepřesáhla 70 % [25]. Velmi podobné závěry poskytuje jiná recentně publikovaná studie zaměřená na výskyt neuropatické komponenty bolesti u různých typů vertebrogenních onemocnění (vč. subakutní radikulopatie a lumbální stenózy) [26]. Uvedené závěry proto naznačují, že reálný výskyt neuropatické komponenty smíšených bolestí je pravděpodobně ještě vyšší, než prokazuje dotazník PainDETECT prostřednictvím původně doporučených cut-off hodnot. Při použití cut-off 11, doporučovaného v Eppingově studii, by v našem souboru pacientů byla neuropatická komponenta bolesti prokázána dokonce u 14 pacientů (60,1 %).
Velmi podobné výsledky naznačuje i druhý z použitých dotazníků, tedy NPSI, vytvořený primárně za účelem detailního popisu klinických symptomů neuropatické bolesti. Alespoň některé z deskriptorů, které jsou využívány v tomto dotazníku a poukazují na možný neuropatický charakter bolesti, jsme prokázali téměř u všech vyšetřovaných pacientů. Žádný z těchto deskriptorů však samozřejmě není pro neuropatickou bolest zcela specifický a může se vyskytovat i u některých pacientů s bolestí nociceptivní. Většina pacientů nicméně vykazovala kombinaci více zmíněných deskriptorů bolesti a také výskyt doprovodných senzitivních symptomů charakteru mravenčení a/ nebo brnění, což dále podporuje hypotézu možného podílu neuropatické komponenty bolesti u pacientů s MD2. Obecně je pro odlišení neuropatické a nociceptivní bolesti pomocí tohoto dotazníku nutné využít právě specifickou kombinaci zmíněných deskriptorů, kterou poskytuje např. pro tento účel vytvořené diskriminační skóre (NPSIcz-D) [15]. S použitím tohoto skóre byl neuropatický charakter bolesti prokázán u 22 pacientů s MD2 (95,7 %). Periferní neuropatická bolest byla tímto způsobem konfirmována u 20 pacientů (87 %). Výskyt neuropatické komponenty bolestí by tak s použitím tohoto dotazníku byl dokonce ještě vyšší než u dotazníku PainDETECT. Tyto hodnoty je však nutné brát s určitou rezervou, protože se nejedná o originální zaměření dotazníku NPSI.
U 47,8 % pacientů byla dle dotazníku PainDETECT neuropatická komponenta bolesti hodnocena jako nepravděpodobná. U těchto pacientů je tedy zřejmě dominující podíl bolesti nociceptivní. Pravděpodobnou nociceptivní komponentu bolesti podporuje i časté užívání nesteroidních antirevmatik, které bylo v naší studii zjištěno v hodnoceném souboru pacientů s MD2 a bolestí, i když většinou pouze s částečným efektem. Bolest u pacientů s MD se tak jeví jako bolest smíšeného typu s variabilním podílem nociceptivní a neuropatické komponenty u různých pacientů.
Komplexní protokol QST je v rámci výzkumných projektů zaměřených na neuropatickou bolest standardně využíván pro potřeby objektivizace poruch senzitivní percepce v oblasti bolesti jako jednoho z významných pilířů nutných pro stanovení diagnózy neuropatické bolesti [18,27,28].
V naší studii jsme u vyšetřených pacientů s MD2 zachytili na DKK především změny v termických modalitách QST (hypestezii pro chlad a trend k hypestezii pro teplo a širšímu teplotnímu rozmezí, které pacient vnímá jako teplotně neutrální). Současně bylo přítomno paradoxní vnímání chladných podnětů jako tepla, tedy porucha diskriminace chladných podnětů, které pacient vnímá jako teplé či horké. Při vyhodnocení mechanických algických parametrů QST testovaných pomocí kalibrovaných špendlíků vykazovali pacienti s MD2 na HKK i DKK signifikantní pokles algického prahu (tedy hyperalgezii) pro ostrou mechanicky vyvolanou bolest. S popsanou hyperalgezií pro mechanické algické podněty je však v rozporu průkaz relativně snížené WUR, která byla zachycena na HKK u pacientů s MD2 při srovnání se zdravými dobrovolníky. Tento rozdíl je však pravděpodobně podmíněn spíše náhodným výskytem vyššího počtu zdravých kontrol s abnormálně zvýšenou časovou sumací v této distribuci v našem kontrolním souboru. Pacienti kontrolního souboru pro tuto studii byli vybráni z větší skupiny zdravých kontrol, jejíž nálezy byly publikovány [18]. V každém souboru zdravých dobrovolníků se vyskytuje určitý počet jedinců s abnormálním nálezem testovaných parametrů (při nastavení norem pomocí 5. a 95. percentilu jde o 10 % hodnot kontrolního souboru). Výběr kontrol do tohoto užšího souboru byl proveden za účelem zajištění co nejlepší shody s demografickými charakteristikami (věk, pohlaví) souboru pacientů s MD2. Shodou okolností však byl při naplnění uvedených kritériích výběru do souboru zařazen vyšší počet kontrol (5) s abnormálně zvýšenou časovou sumací. Tento rozdíl proto nelze interpretovat jako průkaz snížené časové sumace u pacientů s MD2 (kde byly hodnoty tohoto parametru u všech pacientů v buď mezích normy, nebo dokonce s abnormálně zvýšenou časovou sumací).
Pouze jediná dosud publikovaná studie hodnotila kvantitativní testování senzitivity u pacientů s MD2 [29]. Srovnatelně s našimi výsledky kolektiv německých autorů popsal ve své studii pokles algického prahu pro ostrou mechanicky vyvolanou bolest u pacientů s MD2. Zajímavé zjištění v německé studii však bylo to, že pokles algického prahu byl přítomen u obou skupin pacientů s MD2 bez rozdílu, zda pacienti bolest popisovali či nikoliv, zatímco vnímání bolestivých podnětů (hypersenzitivita) a časová sumace bolesti byly zvýšeny pouze ve skupině pacientů s přítomností bolesti. V naší studii jsme vyšetřovali pouze pacienty s bolestí, a k případným změnám senzitivní percepce u pacientů bez bolesti se tedy nemůžeme vyjádřit. Hypersenzitivita pro mechanické algické podněty popisovaná autory citované studie nebyla v našem souboru na skupinové úrovni prokázána. Na individuální úrovni však byla přítomna u řady našich pacientů (5/ 23 pacientů na HKK, 4/ 23 pacientů na DKK), což lze v souladu se snížením algických prahů očekávat. Nejvýznamnější prokázanou abnormitou QST v uvedené německé studii [29] bylo snížení algického prahu pro PPT. V naší skupině vyšetřených pacientů s MD2 jsme významné změny tohoto parametru překvapivě nezaznamenali. Pravděpodobným vysvětlením je významně vyšší počet svalů, na nichž byl v německé studii [29] PPT testován (a to vč. řady svalů proximálních). V naší studii byl tento parametr vyšetřen pouze v rozsahu obvykle testovaném v rámci protokolu DFNS/QST. Nálezy tohoto parametru nejsou tedy vzhledem k rozdílnému rozsahu vyšetření mezi oběma studiemi srovnatelné.
Naše výsledky naopak prokázaly zřetelný trend k výskytu abnormit termického čití, který nebyl zachycen autory publikované německé práce [29]. Tyto změny v našem souboru by mohly poukazovat na možnou dysfunkci tenkých nervových vláken, a jsou tedy v korelaci s charakterem bolesti prokazovaným pomocí dotazníkových nástrojů. Senzitivní profil pacientů s bolesti a MD2 je velmi podobný profilu, který je prokazován u pacientů s fibromyalgií. Podobně jako pacienti v našem souboru s MD2 vykazují i jedinci s fibromyalgií generalizovanou přecitlivělost na mechanické algické podněty, zatímco modality doteku jsou obvykle neovlivněny [30]. Bolest u fibromyalgie je podle recentních studií alespoň u části pacientů podmíněna postižením tenkých nervových vláken [8,23,31], přičemž dysfunkce tenkých nervových vláken se u těchto pacientů manifestuje právě hypestezií pro termické podněty [31]. Bolest při fibromyalgii a MD má přitom řadu podobných rysů a často obdobný charakter. Průkazem této skutečnosti je studie, v níž byla v náhodně vyšetřeném souboru 63 pacientů, kteří byli sledováni pro fibromyalgii, u dvou pacientů geneticky verifikována MD2 [32].
V souhrnu tedy nálezy QST podporují koncept možné poruchy funkce tenkých vláken u pacientů s MD, což svědčí pro přítomnost neuropatické komponenty bolesti u této diagnostické jednotky.
Vyhodnocením sebehodnotících psychologických dotazníků jsme u pacientů s bolesti a MD2 prokázali významně vyšší výskyt depresivních symptomů a vyšší míru katastrofizace bolesti. Zjištěné výsledky však neumožňují rozlišit, zda se zmíněné psychologické charakteristiky vztahují k základnímu onemocnění (MD2) nebo jsou asociovány s bolestí. U MD bývá obvykle popisováno zvýšené riziko deprese (podobně jako u jiných chronických onemocnění), a to zejména vzhledem k progresivnímu charakteru tohoto onemocnění a jeho omezené terapeutické ovlivnitelnosti [33,34]. Kromě asociace se základním onemocněním byl však popsán i zvýšený výskyt depresivní symptomatiky u pacientů s bolesti a MD2 [8]. V případě, že se změny psychologických charakteristik vztahují k bolesti, také není jasné, zda jsou tyto změny důsledkem bolestivého stavu nebo jeho příčinou (což opět nelze ze stávajících dat validně odlišit). Obě situace jsou podle dosud publikovaných studií možné a poměrně časté: metaanalýza 56 studií zaměřená na vzájemný vztah bolesti a deprese u různých onemocnění prokázala průměrný výskyt bolesti u depresivních stavů přibližně v 65 %. Naopak výskyt deprese u pacientů s bolestí se u různých klinických jednotek pohyboval v širokém rozmezí mezi 13 a 85 % [35]. Pro zpřesnění interpretace změn popsaných psychologických charakteristik v rozvoji bolesti a MD2 by proto bylo třeba vyšetřit pomocí identických dotazníků pacienty s MD2, kteří bolesti nemají, a optimálně také dlouhodobě sledovat pacienty s bolesti a MD2 a vyšetřit je pomocí používaných dotazníků opakovaně v různých stadiích onemocnění (což umožní ozřejmit, zda jsou zvýšená míra deprese a další specifické psychologické charakteristiky u pacientů patrné již před rozvojem bolesti nebo se objevují až v jejím
důsledku).
Omezení studie
Určitým omezením prezentované studie je malý rozsah hodnocené skupiny pacientů a absence „kontrolní“ skupiny pacientů s MD2 bez bolesti. Omezený rozsah testované skupiny je podmíněn skutečností, že jde o vzácné onemocnění, navíc často asociované s řadou komorbidit vč. endokrinních onemocnění (např. diabetes mellitus), které představovaly vylučující kritérium pro vstup do této studie (aby nebyly výsledky zkresleny případnými jinými typy bolesti – např. při diabetické polyneuropatii). Navýšení počtu pacientů v testované skupině je tedy obtížně realizovatelné. Větší rozsah testovaného vzorku pacientů by přitom pravděpodobně zvýšil statistickou významnost zachycených rozdílů a zlepšil by tak validitu výstupů. Doplnění kontrolní skupiny bude realizováno v rámci navazujícího projektu, který v současnosti probíhá na pracovišti autorů. Výsledky této pilotní studie by bylo vhodné ověřit rovněž prostřednictvím objektivních metod konfirmujících postižení silných a tenkých nervových vláken (tedy EMG vyšetření a kožní biopsie či korneální konfokální mikroskopie a/ nebo specifických modalit evokovaných potenciálů zaměřených na hodnocení funkce tenkých nervových vláken a/ nebo navazujících nociceptivních drah). Doplnění popisovaných modalit bude též provedeno v popisované navazující studii.
Určitým limitem zjištěných nálezů je také validace použitých dotazníků. Jediným v českém jazyce validovaným dotazníkem pro diagnostiku neuropatické bolesti je dotazník NPSI [15]. Tento dotazník je však primárně zaměřen pouze na detailní popis neuropatické bolesti, a nikoli na její diskriminaci oproti bolesti nociceptivní. K tomuto účelu byl proto v provedené studii využit dotazník PainDETECT. Tento dotazník je v českých podmínkách rutinně využíván v klinické praxi, a to navzdory skutečnosti, že jeho česká verze nebyla validována. Validační studie tohoto dotazníku nyní probíhá na pracovišti autorů. V jejím úvodu byla ověřena využitelnost komerčně distribuované verze dotazníku metodou zpětného překladu („forward-backward translation“) a nebyl shledán rozpor s verzí originální. Dotazník je tedy využitelný v komerčně distribuované verzi, jeho validací se nyní intenzivně zabýváme. Obdobně dotazník Pain Catastrophizing Scale se ve výzkumné praxi používá dlouhodobě. Česká verze dotazníku je dostupná na oficiálních stránkách tvůrců testu. Překlad proběhl formou „forward-backward translation“, avšak dotazník neprošel žádnou oficiální validační studií.
V neposlední řadě může určitý limit představovat i cílené zaměření použitých diagnostických nástrojů na neuropatickou bolest a menší pozornost věnovaná nociceptivní komponentě bolestí. Pro tento účel by zřejmě bylo v navazujících studiích vhodné využít k detailní fenotypizaci pacientů také dotazníky, které lépe reflektují nociceptivní komponentu bolesti.
Závěr
Deskriptory bolesti u pacientů s MD2 v použitých dotaznících a částečně i senzitivní profil těchto pacientů stanovený pomocí QST podporují hypotézu, že bolest u MD2 má také neuropatickou komponentu. Pacienti s bolesti a MD2 vykazují vyšší míru depresivní symptomatiky a katastrofizace bolesti. Provedená studie však neumožňuje rozlišit, zda se změny těchto psychologických charakteristik vztahují k bolesti či k základní diagnóze jako takové.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 12. 1. 2019
Přijato do tisku: 6. 5. 2019
MUDr. Eva Vlčková, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: vlckova.eva@fnbrno.cz
Zdroje
1. Breivik H, Collett B, Ventafridda V et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain Lond Engl 2006; 10(4): 287–333. doi: 10.1016/ j.ejpain.2005.06.009.
2. Leadley RM, Armstrong N, Lee YC et al. Chronic diseases in the European Union: the prevalence and health cost implications of chronic pain. J Pain Palliat Care Pharmacother 2012; 26(4): 310–325. doi: 10.3109/ 15360288. 2012.736933.
3. Reid KJ, Harker J, Bala MM et al. Epidemiology of chronic non-cancer pain in Europe: narrative review of prevalence, pain treatments and pain impact. Curr Med Res Opin 2011; 27(2): 449–462. doi: 10.1185/ 03007995.2010.545813.
4. Guy-Coichard C, Nguyen DT, Delorme T et al. Pain in hereditary neuromuscular disorders and myasthenia gravis: a national survey of frequency, characteristics, and impact. J Pain Symptom Manage 2008; 35(1): 40–50. doi: 10.1016/ j.jpainsymman.2007.02.041.
5. Jensen MP, Abresch RT, Carter GT et al. Chronic pain
in persons with neuromuscular disease. Arch Phys Med
Rehabil 2005; 86(6): 1155–1163. doi: 10.1016/ j.apmr.2004.
11.028.
6. Jensen MP, Hoffman AJ, Stoelb BL et al. Chronic pain in persons with myotonic dystrophy and facioscapulohumeral dystrophy. Arch Phys Med Rehabil 2008; 89(2): 320–328. doi: 10.1016/ j.apmr.2007.08.153.
7. Abresch RT, Carter GT, Jensen MP et al. Assessment of pain and health-related quality of life in slowly progressive neuromuscular disease. Am J Hosp Palliat Care 2002; 19(1): 39–48. doi: 10.1177/ 104990910201900109.
8. Suokas KI, Haanpää M, Kautiainen H et al. Pain in patients with myotonic dystrophy type 2: a postal survey in Finland. Muscle Nerve 2012; 45(1): 70–74. doi: 10.1002/ mus.22249.
9. Heatwole C, Bode R, Johnson N et al. Patient-reported impact of symptoms in myotonic dystrophy type 1 (PRISM-1). Neurology 2012; 79(4): 348–357. doi: 10.1212/ WNL.0b013e318260cbe6.
10. George A, Schneider-Gold C, Zier S et al. Musculo--skeletal pain in patients with myotonic dystrophy type 2.
Arch Neurol 2004; 61(12): 1938–1942. doi: 10.1001/ archneur.61.12.1938.
11. Leonardis L. Peripheral neuropathy in patients with myotonic dystrophy type 2. Acta Neurol Scand 2017; 135(5): 568–575. doi: 10.1111/ ane.12635.
12. Nojszewska M, Łusakowska A, Szmidt-Salkowska E
et al. Peripheral nerve involvement in myotonic dystrophy type 2 – similar or different than in myotonic dystrophy type 1? Neurol Neurochir Pol 2015; 49(3): 164–170. doi: 10.1016/ j.pjnns.2015.04.008.
13. Florence JM, Pandya S, King WM et al. Intrarater reliability of manual muscle test (Medical Research Council scale) grades in Duchenne’s muscular dystrophy. Phys Ther 1992; 72(2): 115–126.
14. Bouhassira D, Attal N, Fermanian J et al. Development and validation of the Neuropathic Pain Symptom Inventory. Pain 2004; 108(3): 248–257. doi: 10.1016/ j.pain.2003.12.024.
15. Šrotová I, Vlčková E, Straková J et al. Validace české verze Neuropathic Pain Symptom Inventory (NPSIcz). Cesk Slov Neurol N 2015; 78/ 111(1): 45–56.
16. Freynhagen R, Baron R, Gockel U et al. painDETECT: a new screening questionnaire to identify neuropathic components in patients with back pain. Curr Med Res Opin 2006; 22(10): 1911–1920. doi: 10.1185/ 030079906X132488.
17. Rolke R, Magerl W, Campbell KA et al. Quantitative sensory testing: a comprehensive protocol for clinical trials. Eur J Pain 2006; 10(1): 77–88. doi: 10.1016/ j.ejpain.2005.02.003.
18. Šrotová I, Vlčková E, Straková J et al. Validace české verze komplexního protokolu kvantitativního testování senzitivity. Cesk Slov Neurol N 2015; 78/ 111(4): 442–452.
19. Backonja MM, Attal N, Baron R et al. Value of quantitative sensory testing in neurological and pain disorders: NeuPSIG consensus. Pain 2013; 154(9): 1807–1819. doi: 10.1016/ j.pain.2013.05.047.
20. Beck AT, Ward CH, Mendelson M et al. An inventory for measuring depression. Arch Gen Psychiatry 1961 : 561–571.
21. Osman A, Barrios FX, Kopper BA et al. Factor structure, reliability, and validity of the Pain Catastrophizing Scale. J Behav Med 1997; 20(6): 589–605.
22. Hilbert JE, Ashizawa T, Day JW et al. Diagnostic odyssey of patients with myotonic dystrophy. J Neurol 2013; 260(10): 2497–2504. doi: 10.1007/ s00415-013-69
93-0.
23. Mense S. Muscle pain: mechanisms and clinical significance. Dtsch Arztebl Int 2008; 105(12): 214–219. doi: 10.3238/ artzebl.2008.0214.
24. Meola G, Cardani R. Myotonic dystrophy type 2: an update on clinical aspects, genetic and pathomolecular mechanism. J Neuromuscul Dis 2015; 2 (Suppl 2): S59–S71. doi: 10.3233/ JND-150088.
25. Epping R, Verhagen AP, Hoebink EA et al. The diagnostic accuracy and test-retest reliability of the Dutch PainDETECT and the DN4 screening tools for neuropathic pain in patients with suspected cervical or lumbar radiculopathy. Musculoskelet Sci Pract 2017; 30 : 72–79. doi: 10.1016/ j.msksp.2017.05.010.
26. Andrasinova T, Kalikova E, Kopacik R et al. Evaluation of the neuropathic component of chronic low back pain. Clin J Pain 2019; 35(1): 7–17. doi: 10.1097/ AJP.00000000 00000653.
27. Finnerup NB, Haroutounian S, Kamerman P et al. Neuropathic pain: an updated grading system for research and clinical practice. Pain 2016; 157(8): 1599–1606. doi: 10.1097/ j.pain.0000000000000492.
28. Vlčková E, Šrotová I. Vyšetření senzitivity. Cesk Slov Neurol N 2014; 77/ 110(4): 402–418.
29. Moshourab R, Palada V, Grunwald S et al. A molecular signature of myalgia in myotonic dystrophy 2. EBioMedicine 2016; 7 : 205–211. doi: 10.1016/ j.ebiom.2016.03.017.
30. Blumenstiel K, Gerhardt A, Rolke R et al. Quantitative sensory testing profiles in chronic back pain are distinct from those in fibromyalgia. Clin J Pain 2011; 27(8): 682–690. doi: 10.1097/ AJP.0b013e3182177654.
31. Üçeyler N, Zeller D, Kahn AK et al. Small fibre pathology in patients with fibromyalgia syndrome. Brain 2013; 136(Pt 6): 1857–1867. doi: 10.1093/ brain/ awt053.
32. Auvinen S, Suominen T, Hannonen P et al. Myotonic dystrophy type 2 found in two of sixty-three persons diagnosed as having fibromyalgia. Arthritis Rheum 2008; 58(11): 3627–3631. doi: 10.1002/ art.24037.
33. Antonini G, Soscia F, Giubilei F et al. Health-related quality of life in myotonic dystrophy type 1 and its relationship with cognitive and emotional functioning. J Rehabil Med 2006; 38(3): 181–185. doi: 10.1080/ 16501970500477967.
34. Moussavi S, Chatterji S, Verdes E et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007; 370(9590): 851–858. doi: 10.1016/ S0140-6736(07)61415-9.
35. Bair MJ, Robinson RL, Katon W et al. Depression and pain comorbidity: a literature review. Arch Intern Med 2003; 163(20): 2433–2445. doi: 10.1001/ archinte.163.20.2433
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2019 Číslo 3
-
Všechny články tohoto čísla
- Editorial
- Neuromuskulární choroby a gravidita
- Sú neskoré komplikácie Parkinsonovej choroby skutočne neskoré? ÁNO
- Jsou pozdní hybné komplikace u Parkinsonovy nemoci skutečně pozdní? NÉ
- Jsou pozdní hybné komplikace u Parkinsonovy nemoci skutečně pozdní?
- Obštrukčné spánkové apnoe a prietok krvi mozgom
- Stručná analýza četnosti použití a spektra animálních modelů ve výzkumu cévních mozkových příhod
- Faktory ovlivňující školní život dětí s epilepsií
- Může být prospěšná endarterektomie zevní karotické tepny? Kritický přehled
- Poruchy cirkadiánního systému u Huntingtonovy choroby – implikace pro terapii světlem
- Zkušenosti s elektrofyziologickou diagnostikou profesionální léze loketního nervu v oblasti lokte
- Vliv multidisciplinárního rehabilitačního programu během hospitalizace na posturální stabilitu a stabilitu chůze u Huntingtonovy nemoci – pilotní studie
- Měření terče zrakového nervu a sítnice pomocí optické koherentní tomografie u nově diagnostikované idiopatické intrakraniální hypertenze bez ztráty zraku
- Test mince v ruce k detekci předstírání oslabeného paměťového výkonu ve srovnání s mírnou kognitivní poruchou a s mírnou demencí u Alzheimerovy nemoci
- Neuropatická komponenta bolesti u pacientů s myotonickou dystrofií 2. typu – pilotní studie
- Ekvivalence alternativních verzí Montrealského kognitivního testu
- Bezrámová a bezpinová metoda pro provedení hluboké mozkové stimulace
- Využití vakuově-kompresní terapie v léčbě syndromu karpálního tunelu jako součást fyzioterapie – pilotní studie
- Aneuryzma arteria choroidea anterior
- Analýza dat v neurologii LXXV. Příklady chybné korelační analýzy
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Test mince v ruce k detekci předstírání oslabeného paměťového výkonu ve srovnání s mírnou kognitivní poruchou a s mírnou demencí u Alzheimerovy nemoci
- Neuromuskulární choroby a gravidita
- Měření terče zrakového nervu a sítnice pomocí optické koherentní tomografie u nově diagnostikované idiopatické intrakraniální hypertenze bez ztráty zraku
- Využití vakuově-kompresní terapie v léčbě syndromu karpálního tunelu jako součást fyzioterapie – pilotní studie
