Specifické protilátky proti beta-tubulinu v diferenciální diagnostice demencí
Specific anti-beta tubulin antibodies in differential diagnosis of dementias
The aim:
To elucidate whether primarily atrophic degenerative affection can be differentiated from the affection of vascular origin by examining antibodies against fragments of the neuronal cytoskeleton in patients with dementia.
Methods:
A set of 37 patients with a syndrome of dementia involved 8 patients with Alzheimer´s disease (AD), 8 patients with frontotemporal lobar degeneration (FTLD), 11 patients with vascular dementia (VD), and 10 patients with mixed dementia (MD). A control set consisted of 10 subjects without disturbed cognitive functions. The diagnosis was established by means of basic clinical examinations, evaluations of MRI and of laboratory methods (determination of phospho-tau protein, tau protein, beta-amyloid in the cerebrospinal fluid). The serums and cerebrospinal fluids (CSF) of these patients were examined using ELISA method for the presence of specific antibodies against the neuronal cytoskeleton, microtubular subunit – beta-tubulin (btcIII).
Results:
In the sets of patients with dementia the levels of IgM antibodies both in CSF and serum did not differ statistically significantly from those in the controls. Positive titres of IgG anti-btcIII antibodies in CSF were shown in 56% patients with VD, in 33% patients with MD, and in 25% patients with FTLD. Positive titres of IgG antibodies against btcIII in serum were revealed in 40% patients with MD, in 36% patients with VD, and in 13% patients with FTLD. No positive result of IgG antibodies in serum as well as in CSF was recorded in a set of patients with AD and in controls.
Conclusion:
Positive titres of antibodies of IgG class against btcIII in serum and CSF were detected in patients with VD and MD in contrast to patients with AD. After verifying the results in a larger set of subjects, the examination of these specific antibodies can make the differential diagnosis of AD, MD and VD more accurate.
Key words:
Alzheimer´s disease, anti-btcIII antibodies, apoptosis, frontotemporal lobar degeneration, markers of dementia, necrosis, mixed dementia, vascular dementia.
Autoři:
D. Škoda 1; J. Hort 1; M. Vyhnálek 1; L. Glosová 1; M. Mináriková 1; P. Jinoch 2; K. Kranda 3; M. Bojar 1
Působiště autorů:
Neurologická klinika, 2. LF UK a FN Motol, Praha
1; VIDIA s. r. o., Jesenice u Prahy
2; Charité Universitätsmedizin, Berlin
3
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(2): 152-157
Kategorie:
Původní práce
Souhrn
Cíl studie:
Objasnit, zda lze na základě vyšetření protilátek proti fragmentům neuronálního cytoskeletu u pacientů s demencí odlišit primárně atroficko-degenerativní postižení od postižení vaskulárního původu.
Metodika:
Soubor 37 pacientů se syndromem demence zahrnoval 8 pacientů s Alzheimerovou chorobou (AD), 8 pacientů s frontotemporální lobární degenerací (FTLD), 11 pacientů s vaskulární demencí (VD) a 10 pacientů se smíšenou demencí (SD). Kontrolní skupinu tvořilo 10 osob bez poruchy kognitivních funkcí. Diagnóza byla stanovena na základě klinického vyšetření, vyhodnocení MRI a laboratorních metod (stanovení fosfo-tau-proteinu, tau-proteinu, beta-amyloidu v mozkomíšním moku). Séra a mozkomíšní moky (MM) těchto pacientů byly vyšetřeny metodou ELISA na přítomnost specifických protilátek proti neuronálnímu cytoskeletu, mikrotubulární podjednotky – beta-tubulinu (btcIII).
Výsledky:
Hladiny protilátek IgM v MM ani v séru nebyly ve skupinách pacientů s demencí statisticky významně odlišné od kontrolní skupiny. Pozitivní titry IgG anti-btcIII protilátek v MM byly prokázány u 56 % pacientů s VD, u 33% pacientů se SD a u 25 % pacientů s FTLD. Pozitivní titry IgG protilátek proti btcIII v séru byly nalezeny u 40 % pacientů se SD, u 36% pacientů s VD a 13 % pacientů s FTLD. Žádný pozitivní výsledek IgG protilátek v séru ani v MM ve skupině pacientů s AD ani v kontrolní skupině zaznamenán nebyl.
Závěr:
Pozitivní titry protilátek třídy IgG proti btcIII byly v séru a v MM prokázány u pacientů s VD a SD na rozdíl od pacientů s AD. Po ověření výsledků na větším souboru pacientů může vyšetření těchto specifických protilátek zpřesnit diferenciální diagnostiku AD, SD a VD.
Klíčová slova:
Alzheimerova choroba, anti-btcIII protilátky, apoptóza, frontotemporální lobární degenerace, markery demence, nekróza, smíšená demence, vaskulární demence
Úvod
Fyziologické stárnutí mozku nemusí být doprovázeno závažnější kognitivní poruchou, přestože u osob starších 70 let jsou oproti jedincům mladšího věku často prokazovány některé morfologické, metabolické i funkční změny [1]. Snaha stanovit riziko vzniku poruchy kognitivních funkcí vede k hledání biomarkerů demence.
Vznik kognitivního deficitu je podmíněn poškozením vyšších korových či podkorových mozkových center nebo jejich spojů. Poruchy paměti, učení, poznávání, plánování, rozhodování, orientace se mohou vyskytovat izolovaně, nebo může být postiženo současně více složek kognice. Tyto poruchy jsou pak podkladem syndromu demence. Nemocní trpí též poruchami chování i nálady, mění se jejich osobnost a jsou narušeny běžné denní aktivity. Demence mohou být atroficko-degenerativního původu jako například Alzheimerova choroba nebo frontotemporální lobární degenerace (AD, FTLD) nebo vaskulární, smíšené, případně jiné sekundární.
Hlavní známé patofyziologické mechanizmy u Alzheimerovy choroby mají vztah k hromadění beta-amyloidu, jehož fragmenty indukující apoptózu neuronu jsou nacházeny v extracelulárně uložených senilních plakách. Druhým proteinem podílejícím se na rozvoji Alzheimerovy choroby je tau-protein, který je jedním z široké množiny MAP (microtubule associated protein) bílkovin. Za fyziologických podmínek se tento protein účastní na integraci vnitřní podpůrné sítě buňky. Tau-protein je u Alzheimerovy choroby v důsledku patologické aktivity proteinkináz hyperfosforylován a hromadí se intracelulárně v nervových spletích (klubkách). Tím je omezen intraneuronální transport látek, organel i vezikul a je narušena funkce neuronu. Při rozpadu neuronů jakéhokoliv původu se koncentrace celkového tau-proteinu v mozkomíšním moku (MM) zvyšuje. Hladina beta-amyloidu se u AD naopak snižuje, což se vysvětluje jeho zvýšenou kumulací v plakách a adhezí k neuronům. Stanovení těchto biomarkerů v MM se využívá v diferenciální diagnostice demencí a pomáhá odlišit AD od jiných demencí, např. FTLD, VD a ostatních typů kognitivních poruch [2,3,4].
Frontotemporální lobární degenerace (FTLD) je termín označující skupinu demencí degenerativní etiologie s převládajícím postižením frontálních laloků a fronto-temporálního pomezí [5].
Vlákna mikrotubulů jsou součástí nejen všech neuronů, ale i ostatních buněk lidského těla. Rozlišujeme rozdílné izotypy tubulinu, tzv. strukturální podjednotky mikrotubulů, jež jsou pak více či méně specifické pro tkáň, ze které pocházejí. Tyto izotypy tubulinu se od sebe liší především v C-terminálním peptidovém konci proteinu [6,7,8]. Pro nervovou tkáň je specifický izotyp btcIII.
Během zániku neuronů vede dezintegrace cytoskeletu k uvolnění jeho fragmentů do extracelulárního prostoru. Přestože o jejich osudu v extracelulární tekutině není mnoho známo, jejich přítomnost v MM byla detekována u pacientů s různými neurologickými chorobami [9,10]. Právě mikrotubulární fragmenty v některých případech spouštějí tvorbu specifických autoprotilátek proti několika typům sekvencí aminokyselin tubulinových podjednotek, které jsou měřitelné v MM i v séru [11-14]. K takovému procesu defragmentace cytoskeletu dochází masivně následkem vaskulárního postižení. Na tomto procesu se účastní jak apoptóza – řízená smrt buňky, tak především nekróza – masivní destrukce větší populace buněk.
Vzhledem k uvolnění většího množství antigenu při současném narušení hematoencefalické bariéry u ischemického postižení předpokládáme větší tvorbu protilátek proti fragmentům cytoskeletu u pacientů s vaskulární a smíšenou demencí oproti pacientům s demencí primárně degenerativní etiologie.
Naším cílem bylo stanovit marker neuronální destrukce detekcí specifických protilátek v séru i v MM proti fragmentům cytoskeletu. Objasnit, zda je možné na základě vyšetření titrů protilátek proti fragmentům neuronálního cytoskeletu u pacientů s demencí odlišit postižení primárně atroficko-degenerativní etiologie od vaskulární demence.
Materiál a metoda
Do souboru bylo zařazeno 37 pacientů (21 žen a 16 mužů) s jednoznačně prokázanou poruchou kognitivních funkcí a 10 jedinců, kteří tvořili kontrolní skupinu (6 žen a 4 muži). Věkový průměr pacientů s kognitivním deficitem byl 66,9 ± 9,0 let a jedinců kontrolní skupiny 68,9 ± 7,3 let (tab.1). Kontrolní soubor tvořili pacienti Neurologické kliniky FN v Motole a 2. LF UK Praha bez poruchy kognitivních funkcí. Lumbální punkce byla v jejich případě provedena pro podezření na neuroinfekci (manifestující se jako vertebrogenní či radikulární syndrom, n = 6, nebo jako periferní paréza lícního nervu, n = 4), které se nepotvrdilo. Ušetření kognitivních funkcí bylo ověřeno pomocí Mini-Mental State Examination (MMSE).
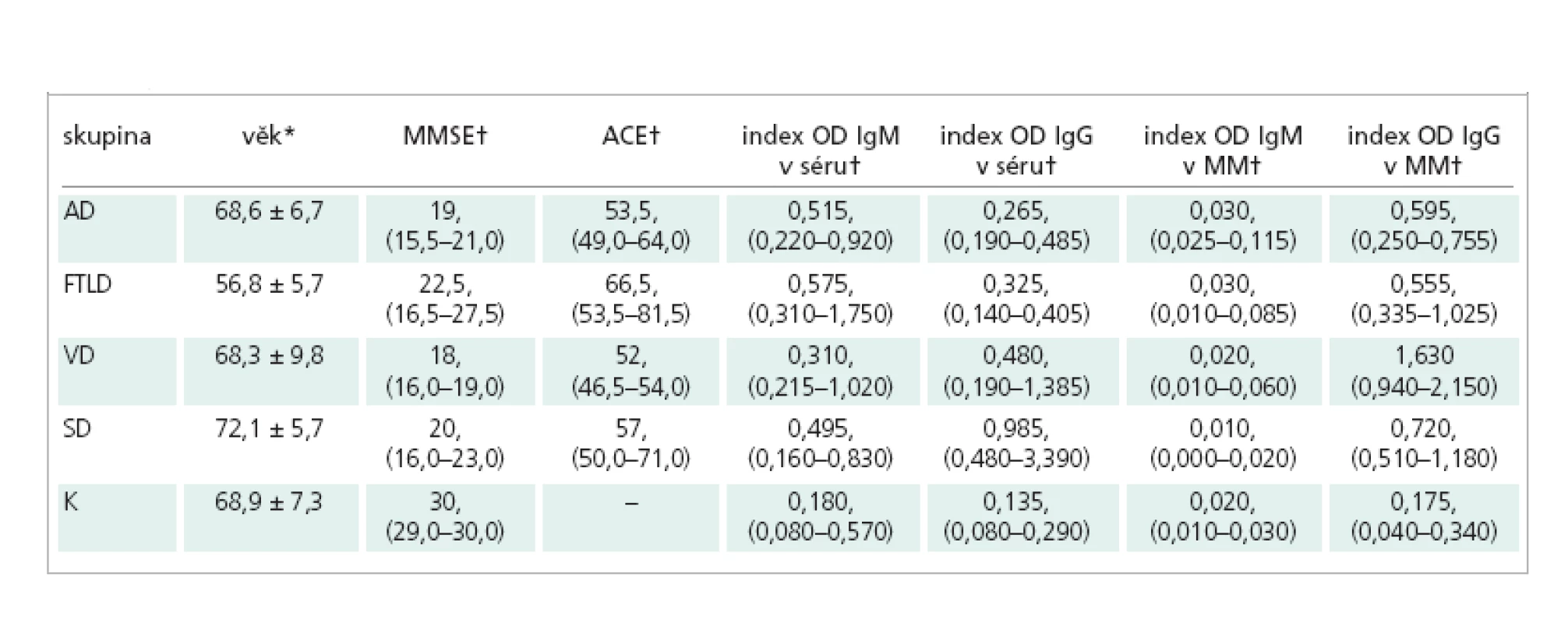
Všichni pacienti s demencí byli vyšetřeni neurologicky a porucha kognitivních funkcí byla objektivizována pomocí MMSE a Addenbrooke´s Cognitive Examination – ACE, kdy hranice pro kognitivní deficit 88 bodů ze 100 má senzitivitu 93 % a specificitu 71 % [15].
Soubor pacientů s kognitivní poruchou se skládal z 8 pacientů s Alzheimerovou chorobou (AD - 2 muži a 6 žen, věk 68,6 ± 6,7), 8 pacientů s frontotemporální lobární degenerací (FTLD - 2 muži a 6 žen, věk 56,8 ± 5,7), 11 pacientů s vaskulární demencí (VD - 7 mužů a 4 ženy, věk 68,3 ± 9,8) a 10 pacientů se smíšenou demencí (SD - 5 mužů a 5 žen, věk 72,1 ± 5,7). V případě pacientů s FTLD šlo o 1 jedince se sémantickou demencí [16] a 7 jedinců s převažujícími behaviorálními příznaky. U 4 z těchto 7 pacientů se kognitivní deficit vyskytoval společně s onemocněním motoneuronu. Charakteristika jednotlivých skupin pacientů je uvedena v tab. 1. Dle kritérií NINCDS-ADRDA (National Institute of Neurological and Communicative Diseases and Stroke -Alzheimers´s Disease and Related Disorders Association) byla stanovena pravděpodobná AD [17], dle kritérií NINDS-AIREN (National Institute of Neurological Disorders and Stroke - Association Internationale pour la Recherche et l’Enseignement en Neurosciences) pravděpodobná VD [18]. Nearyho kritéria byla použita pro stanovení diagnózy FTLD [19]. Do skupiny primárně atroficko–degenerativních (AD, FTLD) byli zařazeni jen pacienti s Hachinski skóre pod 4.
Biologické materiály (krev, MM) byly odebrány standardním způsobem pro rutinní vyšetření pacientů se syndromem demence. Pacienti podepsali informovaný souhlas s vyšetřením a s provedením lumbální punkce. Použité postupy byly schváleny odpovědnou etickou komisí a byly v souladu s Helsinskou deklarací z roku 1975, ve znění revize z roku 1983.
Všichni pacienti byli vyšetřeni magnetickou rezonancí (MRI, Philips Gyroscan 1,5 T, Philips, Švédsko). Toto vyšetření umožnilo vyloučit jiné příčiny demence a zhodnotit množství a rozsah vaskulárních změn. Stupeň postižení bílé hmoty byl kvantifikován jednoduchým skórovacím systémem, kdy stupeň 0 odpovídal nepostižené bílé hmotě bez ložiskových změn, stupeň 1 mírnému postižení s tečkovitými ložisky gliózy a stupeň 2 významnému postižení bílé hmoty [20].
Biomarkery v MM (fosfo-tau-protein, tau-protein a beta-amyloid), které byly použity ke zpřesnění stanovené diagnózy, byly vyšetřeny ELISA sety od firmy Innogenetics (Gent, Belgie).
Diagnóza pravděpodobné AD byla ve většině případů podložena nálezem zvýšené hladiny celkového tau-proteinu, fosfo-tau-proteinu a snížené hladiny beta-amyloidu v MM. U těchto pacientů neprokázalo MRI vyšetření mozku ložiskové léze ani významné difúzní signálové změny.
Diagnózu VD dokládala stanovená normální hladina fosfo-tau-proteinu, variabilní hladina tau-proteinu a ve většině případů normální koncentrace beta-amyloidu v MM.
Všichni pacienti, u kterých byla stanovena diagnóza VD či smíšené demence, měli vyjádřeny vaskulární změny na T1 i T2 vážených MRI sekvencích charakteru ložiskového postižení nebo difúzních signálových změn, které odpovídaly gliovým změnám. Postižení bílé hmoty u těchto pacientů dosahovalo stupně 2 [20]. Hachinski skóre u těchto pacientů bylo vyšší než 4.
Koncentrace anti-btcIII protilátek v séru i v MM byla stanovena testem ELISA (VIDIA s.r.o., Vestec u Prahy, Česká Republika). V testu jsou protilátky vychytávány na peptidový antigen odvozený od C-koncové části btcIII [21] a ukotvený na dně polystyrenových jamek. Z naměřené hodnoty optické denzity (OD) byl vypočítán index OD jako podíl OD u daného vzorku a hodnoty cut-off. Hranice pozitivity pro sérum byla stanovena výrobcem (index OD > 1,2 pro IgM i IgG). Pro MM jsme použili rozlišení na pozitivní a negativní na základě výpočtu průměrné hodnoty indexu OD u kontrolního souboru plus 3 směrodatné odchylky (index OD pro IgM > 0,29 a pro
IgG > 1,06).
Při statistickém zpracování byla data nejdříve prověřena testem normality Shapiro-Wilk, a protože rozložení hodnot neodpovídalo normálnímu Gaussovu rozložení, byl pro porovnávání indexů OD mezi skupinami použit neparametrický Mannův-Whitneyův test.
Dále byl ve skupinách statisticky porovnáván výskyt indexů OD vyšší než hranice pozitivity. Pro porovnávání byly použity kontingenční tabulky hodnocené Fischerovým exaktním testem. Ve všech statistických analýzách byla přijata hodnota α = 0,05 jako hranice statistické významnosti. Statistické analýzy byly provedeny v programu SPSS verze 11.0 pro Windows (SPSS, Chicago, USA).
Výsledky
Byla změřena hladina anti-btcIII protilátek třídy IgM a třídy IgG v séru a v MM u pacientů s AD, s FTLD, s VD, se smíšenou demencí a u kontrolní skupiny. Zvlášť byla hodnocena hladina protilátek a zvlášť četnost nálezu pozitivního titru protilátek. Z důvodu malého množství vzorku MM nebyl u 2 u pacientů ze skupiny VD a 1 pacienta ze skupiny SD testován MM na přítomnost protilátek proti btcIII.
Všechny skupiny pacientů s demencí měly statisticky významně zvýšeny protilátky IgG v MM v porovnání s kontrolní skupinou. Nejvyšší hladina anti-btcIII IgG protilátek v MM byla naměřena u VD, kde byla statisticky významně vyšší než u AD a FTLD (p = 0,011 a p = 0,036; graf 1). Při porovnání hladin u VD a skupiny SD a při porovnání hladin mezi AD a FTLD nebyl prokázán statisticky významný rozdíl.

a) Analýza hladin protilátek
Pacienti s FTLD, VD a SD měli oproti kontrolní skupině statisticky signifikantně zvýšenou hladinu IgG protilátek v séru. Nejvyšší hladina IgG protilátek v séru byla pozorována u smíšených demencí, statisticky významně vyšší než u AD a FTLD (p = 0,021 a p = 0,016; graf 2). Shodně jako v MM, při porovnání sérových hladin anti-btcIII IgG u VD a smíšených demencí a mezi AD a FTLD nebyl nalezen statisticky významný rozdíl. Nenalezli jsme statisticky signifikantní rozdíl hladin anti-btcIII protilátek třídy IgG v séru u pacientů s AD v porovnání s kontrolní skupinou.

Hladiny protilátek třídy IgM v MM ani v séru nebyly ve skupinách pacientů s demencí statisticky významně odlišné od kontrolní skupiny.
b) Analýza četnosti nálezů pozitivních titrů protilátek
Při analýze četnosti nálezu pozitivních titrů protilátek byly v MM prokázány titry IgG proti btcIII u 56 % (5/9) pacientů s VD, u 33 % (3/9) pacientů se SD a u 25 % (2/8) pacientů s FTLD. Žádný pozitivní výsledek nebyl zaznamenán ve skupině pacientů s AD a ani v kontrolní skupině. Počet pozitivních nálezů IgG protilátek v MM byl při analýze v kontingenčních tabulkách statisticky významný pro skupinu pacientů s VD (p = 0,020) ve srovnání s pacienty s AD a s kontrolní skupinou. Ve skupině pacientů se SD nedosahoval počet pozitivních nálezů při stejném porovnání statistické významnosti.
V séru byly nalezeny pozitivní titry IgG protilátek proti btcIII u 40 % (4/10) pacientů se SD, u 36 % (4/11) pacientů s VD, u 13 % (1/8) pacientů s FTLD. Stejně jako v MM, tak ani v séru nebyl zaznamenán ve skupině pacientů s AD ani v kontrolní skupině žádný pozitivní nález v případě IgG protilátek. Statisticky významný ve srovnání s kontrolní skupinou byl nález u SD, ostatní výsledky nedosahovaly hranice významnosti.
Ve třídě IgM protilátek proti btcIII byl v MM naměřen pozitivní titr v jednom případě u AD a v jednom případě u FTLD. V případě pacienta s AD se jednalo o izolovaný nález zvýšené hladiny protilátek. Pacient s FTLD měl pozitivní nález i v IgM třídě v séru a v třídě IgG v MM.
V séru byla naměřena pozitivní hladina anti-btcIII protilátek třídy IgM u 38 % (3/8) pacientů s FTLD, u 18 % (2/11) pacientů s VD a u 10 % (1/10) pacientů se SD. V kontrolní skupině a ve skupině s AD nebyl zachycen žádný případ zvýšené hladiny IgM protilátek v séru. Výsledky pro IgM v séru ani v MM nedosahovaly statistické významnosti při porovnání jednotlivých skupin pacientů.
Pozitivní titry protilátek proti btcIII byly naměřeny celkem ve 24 vzorcích séra nebo MM. Jen ve 3 případech (6 %) byl zjištěn pozitivní titr anti-btcIII protilátek současně ve třídě IgG a ve třídě IgM.
Diskuse
Vzhledem k tomu, že se hladiny protilátek třídy IgM v MM ani v séru statisticky významně nelišily ve skupinách pacientů s demencí od skupiny kontrolní, zaměřili jsme se především na protilátky třídy IgG.
U pacientů s diagnózou pravděpodobné AD, podpořené typickým nálezem v MM, nebyly nalezeny pozitivní titry anti-btcIII protilátek třídy IgG v séru ani v MM. Jejich absence nevylučuje aktivaci specifického imunitního systému proti fragmentům neuronálních mikrotubulů u tohoto onemocnění. Populace neuronů podléhající apoptóze nemusí být v programové smrti synchronizována a nemusí tak najednou dojít k uvolnění většího množství fragmentů cytoskeleletu.
Pozitivní titry protilátek byly detekovány v případě primárně neurodegenerativního postižení u pacientů s FTLD s dominujícími behaviorálními příznaky, a to především u těch pacientů, u nichž se kognitivní deficit vyskytoval společně s onemocněním motoneuronu. Pacient se sémantickou demencí neměl pozitivní titry třídy IgM ani IgG v séru ani v MM. Degenerace čelních a spánkových laloků vede u tohoto onemocnění k uvolnění fragmentů cytoskeletu do extracelulárního prostoru a následné reakci imunitního systému. Příčina není v plné míře objasněna. Někteří autoři se domnívají, že rozpad neuronů a jejich vláken je u této choroby primárně způsoben dezintegrací aberantního neuronálního cytoskeletu [22].
Rozpad neuronů a následné uvolňování části jejich cytoskeletu do mimobuněčného prostoru není kontinuální, ale má spíše skokovitý průběh, při kterém jsou určité části neuronů degradovány rychleji než ostatní. Aby byl takovýto proces s jistotou spolehlivě měřitelný, je nutné předpokládat, že dochází k synchronizované ztrátě celých neuronálních skupin. Takovýto děj lze očekávat spíše u postižení vaskulárního typu, při němž naráz hynou celé populace buněk.
Vzhledem k tomu, že jsme v literatuře nenašli žádnou zmínku o stanovování specifických protilátek proti btcIII či samotného proteinu v tělních tekutinách u pacientů s demencí, podpořili jsme naši hypotézu nálezy autorů, kteří stanovovali u pacientů s demencí hladiny jiných komponent neuronálního cytoskeletu. Zvýšené množství fragmentů neurofilament v MM bylo pozorováno u pacientů s VD v porovnání s kontrolní skupinou, zatímco tau-protein byl v normě [23]. V další práci autoři prokázali zvýšené množství fragmentů cytoskeletu v MM u VD i AD, byla však nalezena asociace mezi hladinou neurofilament a přítomností změn bílé hmoty [20]. V obou případech se ovšem jednalo o podjednotky neurofilament typu light. Také jiní autoři prokázali v signifikantní míře zvýšenou hladinu cytoskeletálních podjednotek oproti kontrolní skupině v MM i u jiných typů demencí než VD [24,25].
Dostupné informace z literatury o stanovování specifických anti-btcIII protilátek v séru pacientů s neurologickým onemocněním se týká pacientů s neuroblastomem [26] a s polyneuropatií [27].
V souladu s naší hypotézou byla pozorována zvýšená hladina anti-btcIII protilátek v séru i v MM proti fragmentům cytoskeletu u pacientů, kteří měli současně významné vaskulární změny patrné na MRI. Přítomnost ložisek gliózy lze zpravidla prokázat periventrikulárně, což může souviset s prezentací antigenu imunitnímu systému. U pacientů s kognitivní poruchou na vaskulárním podkladě je nabídka antigenu v podobě degradovaných fragmentů cytoskeletu následkem ischemického postižení zřejmě mnohem vyšší, nebo její rychlost převyšuje schopnost organizmu cytoskleletální antigeny degradovat.
Závěr
Pozitivní titry protilátek třídy IgG proti btcIII vyšetřované v séru i v MM pacientů s demencí byly prokázány u pacientů s VD a SD narozdíl od pacientů s AD. Jedná se pravděpodobně o reakci na masivní neuronální ztrátu. Nález pozitivních titrů anti-btcIII protilátek v séru i v MM u pacientů s FTLD svědčí o rozdílných příčinách vzniku klinických příznaků v případě různých atroficko–degenerativních onemocnění.
Vzhledem k absenci validních literárních údajů o využití stanovení specifických protilátek proti btcIII se autoři domnívají, že tuto práci lze považovat za nadějný pilotní projekt. Vyšetření protilátek třídy IgM proti btcIII v séru ani v MM nemá podle našich nálezů pro diferenciální diagnostiku vaskulární a atroficko–degenerativní demence takový význam jako vyšetření protilátek třídy IgG. V případě potvrzení našich výsledků by stanovení anti-btcIII protilátek třídy IgG v séru a v MM mohlo sloužit jako doplňkový test pro odlišení vaskulární či smíšené demence od AD, kdy nález jejich pozitivních titrů v séru nebo v MM svědčí proti diagnóze AD.
Tato studie byla podpořena granty GAČR 309/05/0693 a IGA, NR8114.
MUDr. David Škoda
Neurologická klinika dospělých
2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: david-skoda@seznam.cz
Přijato k recenzi: 29. 12. 2005
Přijato do tisku: 22. 8. 2006
Zdroje
1. Hedden T, Gabrieli JD. Healthy and pathological processes in adult development: new evidence from neuroimaging of the aging brain. Curr Opin Neurol 2005; 18 : 740-7.
2. Glosová L, Hort J, Bojar M, Škoda D. Vyšetření celkového tau proteinu, phospho-tau proteinu a beta-amyloidu v mozkomíšním moku – naše první zkušenosti. Klin Biochem Metabol 2003; 12 : 113-6.
3. Andreasen N, Sjogren M, Blennow K. CSF markers for Alzheimer´s disease: total tau, phospho-tau a Abeta42. World J Biol Psychiatry 2003; 4 : 147-55.
4. Blennow K. Cerebrospinal fluid protein biomarkers for Alzheimer's disease. NeuroRx 2004; 1 : 213-25.
5. Neary D, Snowden J, Mann D. Frontotemporal dementia. Lancet Neurol 2005; 4 : 771-80.
6. Sullivan KF, Cleveland DW. Identification of conserved isotype-defining variable region sequences for four vertebrate beta tubulin polypeptide classes. Proc Natl Acad Sci USA 1986; 83 : 4327-31.
7. Banerjee A, Roach MC, Trcka P, Luduena RF. Increased microtubule assembly in bovine brain tubulin lacking the type III isotype of b-tubulin. J Biol Chem 1990; 265 : 1794-9.
8. Stubbs EB Jr, Fisher MA, Siegel GJ. Anti-tubulin antibodies in a sensorimotor neuropathy patient alter tubulin polymerization. Acta Neuropathol (Berl) 1998; 95 : 302-5.
9. Norgren N, Rosengren L, Stigbrand T. Elevated neurofilament levels in neurological diseases. Brain Research 2003; 987 : 25-31.
10. Semra YK, Seidi OA, Sharief MK. Heightened intrathecal release of axonal cytoskeletal proteins in multiple sclerosis is associated with progressive disease and clinical disability. J Neuroimmunol 2002; 122 : 132-9.
11. Silber E, Semra YK, Gregson NA, Sharief MK. Patients with progressive multiple sclerosis have elevated antibodies to neurofilament subunit. Neurology 2002; 58 : 1372-81.
12. Dighiero G, Guilbert B, Avrameas S. Naturally occurring antibodies against nine common antigens in humans sera. II. High incidence of monoclonal Ig exhibiting antibody activity against actin and tubulin and sharing antibody specificities with natural antibodies. J Immunol 1982; 128 : 2788-92.
13. Avrameas S, Ternynck T. The natural autoantibodies system: between hypotheses and facts. Mol Immunol 1993; 30 : 1133-42.
14. Terryberry JW, Thor G, Peter JB. Autoantibodies in neurodegenerative diseases: antigen specific frequencies and intrathecal analysis. Neurobiol Aging 1998; 19 : 205-16.
15. Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer's disease and frontotemporal dementia. Neurology 2000; 55 : 1613-20.
16. Vyhnálek M, Škoda D, Varjassyová A, Hort J. Sémantická demence – důkaz mnohotvárnosti paměťových procesů. Neurol pro praxi 2005; 6: 330-332.
17. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology 1984; 34 : 939-44.
18. Roman GC, Tatemichi TK, Erkinjuntti T, Cummings JL, Masdeu JC, Garcia JH et al. Vascular dementia: diagnostic criteria for research studies. Report of the NINDS-AIREN International Workshop. Neurology 1993; 43 : 250-60.
19. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51 : 1546-54.
20. Sjogren M, Blomberg M, Jonsson M, Wahlund LO, Edman A, Lind K et al. Neurofilament protein in cerebrospinal fluid: a marker of white matter changes. J Neurosci Res 2001; 66 : 510-6.
21. Dráberová E, Lukas Z, Ivanyi D, Viklický V, Dráber P. Expression of class III ß-tubulin in normal and neoplastic human tissues. Histochem Cell Biol 1998; 109 : 231-9.
22. Sjogren M, Wallin A. Pathophysiological aspects of frontotemporal dementia-emphasis on cytoskeleton proteins and autoimmunity. Mech Ageing Dev 2001; 122 : 1923-35.
23. Wallin A, Sjögren M. Cerebrospinal fluid cytoskeleton proteins in patients with subcortical white-matter dementia. Mech Ageing Dev 2001; 122 : 1937-49.
24. Rosengren LE, Karlsson JE, Sjogren M, Blennow K, Wallin A. Neurofilament protein levels in CSF are increased in dementia. Neurology 1999; 52 : 1090–3.
25. Hu YY, He SS, Wang XC, Duan QH, Khatoon S, Iqbal K et al. Elevated levels of phosphorylated neurofilament proteins in cerebrospinal fluid of Alzheimer disease patients. Neurosci Lett 2002; 320 : 156–60.
26. Prasannan L, Misek DE, Hinderer R, Michon J, Geiger JD, Hanash SM. Identification of beta-tubulin isoforms as tumor antigens in neuroblastoma. Clin Cancer Res 2000; 6 : 3949-56.
27. Stubbs EB Jr, Fisher MA, Wilson JR, Siegel GJ. High-titer immunoglobulin M antibody to nerve-specific class III beta-tubulin in the serum of a patient with sensory demyelinating polyneuropathy. Muscle Nerve 1996; 19 : 1638-9.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 2
-
Všechny články tohoto čísla
- Úvodník
- Súčasný pohľad na diagnostiku a terapiu afázie
- Epilepsie a cyklus spánku a bdění
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
- Význam MR v indikaci systémové trombolýzy – analýza prvních 30 pacientů
- Specifické protilátky proti beta-tubulinu v diferenciální diagnostice demencí
- Abnormální mikrostruktura spánku a autonomní odpověď u narkolepsie
- Riziko vzniku vaskulární příhody při léčbě fluvastatinem a fenofibrátem
- Korelace ptiO2 a apoptózy u fokální mozkové ischemie a vliv systémové hypertenze
- Turbulence srdeční frekvence v posouzení kardiální autonomní funkce u migreniků
- Radiochirurgická léčba schwannomu trojklaného nervu pomocí Leksellova gama nože
- EFNS Guidelines on pharmacological treatment of neuropathic pain - komentář
- Jednorázové intratékální podání baklofenu a následné zavedení pumpového systému v léčbě těžké spasticity u osob s roztroušenou sklerózou
- Chirurgická léčba ependymomů krční a horní hrudní míchy
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Bazaliom s propagací do mostomozečkového koutu asociovaný s ipsilaterálním neurinomem akustiku – kazuistika
- Solitární fibrózní tumor mening
-
Analýza dat v neurologii. II.
Frekvenční analýza jako první vhled do dat - Webové okénko
- Zpráva o 5. CENS mikrovaskulárním workshopu
- Výroční kongres Neurochirurgické společnosti Indonésie ve spolupráci se Světovou federací neurochirurgických společností (WFNS).
- Prof. MUDr. Jaroslav HYMPÁN 95 ročný
- Prof. MUDr. Zdeněk Kadaňka, CSc. – 65 let
- Recenze
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Epilepsie a cyklus spánku a bdění
- Súčasný pohľad na diagnostiku a terapiu afázie
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
