Diagnostika, symptomatika a nálezy u onemocnění a poruch autonomního nervového systému v neurologii
Diagnostics, symptomatology and findings in diseases and disorders of the autonomic nervous system in neurology
Disorders of the autonomic nervous system are more common in neurology practice than previously recognized in diagnostic conclusions. Besides the primary involvement of the autonomic nervous system, there are sympathetic or parasympathetic (especially vagal) dysfunctions associated with other diseases of the central or peripheral nervous system. The aim of this paper is to provide a short overview of the clinical symptomatology of autonomic dysfunctions, the examination methods of the autonomic nervous system, especially those available and applicable in clinical neurology practice, and furthemore, the clinical pictures of generalized and localized autonomic dysfunctions. The most important autonomic examinations focus on the cardiovascular system, assessing both heart rate and blood pressure changes in appropriately selected autonomic tests. The cardiovascular autonomic reflex tests and the heart rate variability assessment are the most commonly used diagnostic tools. The examination methods of the autonomic regulations in other systems of the human body are described in this paper in a brief overview. The latter part of this article is dedicated to selected diseases and clinical symptomatology, among generalized (systematic) disorders of the autonomic nervous system, diabetic autonomic polyneuropathy and autonomic polyneuropathies of other causes which are discussed in greater detail. This is followed by an overview of autonomic disturbances and dysfunctions of central origin that may constitute either major or minor symptoms of neurological diseases. The paper further describes clinical features of localized autonomic disturbances. A simple diagnostic scheme for basic evaluation of the autonomic functions in clinical neurology practice is proposed at the end of this paper.
Key words:
autonomic nervous system diseases – sympathetic nervous system – parasympathetic nervous system – signs and symptoms – diagnoses and examinations – neurologic examination – diagnostic techniques, neurological – diabetic autonomic neuropathy – heart rate determination – spectrum analysis
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
J. Opavský
Působiště autorů:
Katedra fyzioterapie, Fakulta tělesné kultury, Univerzita Palackého v Olomouci
Vyšlo v časopise:
Cesk Slov Neurol N 2018; 81(6): 625-644
Kategorie:
Minimonografie
doi:
https://doi.org/10.14735/amcsnn2018625
Souhrn
Postižení autonomního nervového systému je v neurologické praxi častější, než jak je vykazováno v diagnostických závěrech. Vedle samostatného primárního postižení této součásti nervového systému provázejí příznaky postižení sympatiku nebo parasympatiku (hlavně vagu) onemocnění a poruchy centrálního nebo periferního nervového systému. Cílem tohoto příspěvku je podat stručný přehled o klinické symptomatologii poruch autonomního nervového systému, o vyšetřovacích možnostech autonomních funkcí, zejména dostupných v klinické neurologické praxi, a o klinických obrazech generalizovaných nebo lokalizovaných autonomních poruch. V diagnostice autonomních dysfunkcí má hlavní význam vyšetření kardiovaskulárního systému, a to jak srdeční frekvence, tak hodnot krevního tlaku ve vhodně zvolených testech. Nejčastěji využívanými jsou zde kardiovaskulární autonomní reflexní testy a hodnocení variability srdeční frekvence. Vyšetřovací metody autonomních regulací v jiných systémech organizmu jsou v práci uvedeny ve stručném přehledu. V části věnované klinické symptomatologii a jednotlivým onemocněním je z generalizovaných (systémových) poruch autonomního nervového systému věnována největší pozornost diabetické autonomní polyneuropatii a vedle nich autonomním polyneuropatiím dalších etiologií. Po periferních postiženích následuje stručný přehled centrálních autonomních poruch a dysfunkcí, které jsou buď hlavními, nebo vedlejšími obtížemi neurologických onemocnění. Klinická část dále zahrnuje charakteristiky lokalizovaných autonomních poruch. Na závěr článku je navrženo základní orientační schéma vyšetření autonomních funkcí v klinické neurologické praxi.
Klíčová slova:
nemoci autonomního nervového systému – sympatický nervový systém – parasympatický nervový systém – známky a příznaky – diagnózy a vyšetření – neurologické vyšetření – diagnostické techniky neurologické – diabetická autonomní neuropatie – hodnocení srdeční frekvence – spektrální analýza
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Úvod
Název autonomní nervový systém (ANS) vznikl z původních, později překonaných představ, že funguje samostatně, bez závislosti na řízení strukturami vyšších oddílů CNS, vč. korových. Starší názory byly proto revidovány a bylo zjištěno, že fyziologická činnost ANS je podmíněna součinností části centrální a periferní [1,2]. Přestože název obsahuje termín „autonomní“, je činnost tohoto systému přísně fyziologicky determinována. Citlivě reaguje na hormonální a humorální změny a na nervové podněty z vnitřního i vnějšího prostředí.
V některých pracích, zejména publikovaných v jazyce německém, se dosud objevuje označení tohoto systému jako „vegetativní“. V souladu s anatomickou terminologií se nyní má preferovat adjektivum „autonomní“.
Autonomní nervový systém se významně podílí na udržování homeostázy organizmu. Reguluje funkce kardiovaskulárního, respiračního, trávicího, močového a pohlavního systému, ovlivňuje metabolické, endokrinní funkce a termoregulaci a významně se podílí na adaptačních reakcích na stres. Doprovází emoční a behaviorální projevy a podílí se na nich. Patologické procesy vedou k jeho dysfunkcím, které mají dopad do funkce mnoha orgánových systémů, homeostázy a rovněž na psychický stav. ANS reaguje individuálně odlišně na fyziologické i patofyziologické podněty. Dysfunkce jednotlivých orgánů nebo tkání vyvolávají lokalizované nebo generalizované autonomní odpovědi [3]. K autonomní dysregulaci dochází též např. při horečce nebo nocicepci vyvolávající bolest. Významný faktor ovlivňující funkční stav ANS představují farmaka. Rovněž stav vědomí, psychický stav a nálada podstatně ovlivňují činnost ANS [4].
Závažný problém klinické medicíny v ČR, vč. neurologie, představuje nedostatečná nebo nedostatečně citlivá registrace a diagnostika poruch ANS. V klinické praxi bývají často přehlíženy významné abnormální autonomní projevy, a to i u vyšetření těch pacientů, jejichž obtíže nasvědčují možnosti autonomní dysfunkce. Na většině neurologických pracovišť u nás chybějí objektivizační metody k jejich průkazu. Proto má tento příspěvek za jeden z cílů podat stručný přehled o dostupných metodách vyšetřování ANS v neurologii a dále o spektru onemocnění a stavů spojených s postižením této součásti nervového systému.
Základní členění a obecné principy funkcí autonomního nervového systému
Činnost ANS je podmíněna složitými reflexními a humorálními regulacemi. Jeho reflexní okruhy jsou v periferní části tvořeny složkou aferentní (viscerosenzitivní a glanduloceptivní) a složkou eferentní (visceromotorickou a sekretomotorickou). Jejich součinnost podmiňuje determinované odpovědi tohoto systému na nejrůznější druhy podnětů z vnitřního i zevního prostředí.
Tradiční anatomické pojetí rozděluje ANS na dva subsystémy – sympatikus (pars sympathica) a parasympatikus (pars parasympathica). Později byla objevena i součást třetí, tzv. enterický (enterální, střevní nebo intramurální) subsystém [5,6]. Tento subsystém je složitě modulován, vč. vlivů sympatiku a parasympatiku, a zahrnuje i vlastní specifickou neadrenergní a necholinergní neurotransmisi [7].
Funkční stav subsystémů sympatiku a parasympatiku (vagu) se klasicky označoval jako jejich tonus. Jejich nerovnováha (sympatikotonie, resp. vagotonie) byla popisována jako změny tonu těchto subsystémů. Termín tonus by však měl být v souvislosti s ANS opuštěn, protože jak sympatikus, tak i parasympatikus mohou mít odlišnou míru aktivace (zvýšení i snížení činnosti) v různých částech organizmu, a nelze je proto stanovit celkově. Dalším důvodem, proč nelze změny činnosti ANS označovat jako změny jednotlivých subsystémů, je zjištění, že v mnoha situacích se sympatikus a parasympatikus nechovají antagonisticky, nýbrž koordinovaně, tj. že např. v některých situacích dochází k současnému zvýšení aktivity obou těchto subsystémů [8].
Hodnocení funkcí ANS je proto ztíženo nejen interakcemi jeho subsystémů, nýbrž i měnlivou citlivostí jednotlivých receptorů. Při zvýšené nabídce transmiterů nebo látek působících agonisticky na tyto receptory dochází ke snižování citlivosti a počtu receptorů. Tento stav se označuje jako regulace dolů (down regulation) neboli hyposenzitivita receptorů. Naopak při nedostatku transmiterů (nebo jejich farmakologických agonistů) se zvyšuje citlivost a počet receptorů a stav se nazývá „up regulation“. Funkčně se tento stav projevuje jako hypersenzitivita receptorů.
Diagnostika nemocí a poruch autonomního nervového systému
Při podezření na postižení ANS by měla být základem podrobná anamnéza zaměřená na možné projevy dysfunkcí tohoto systému, které jsou uvedeny v tab. 1. Tato anamnéza je někdy časově náročná a musí být systematická. Proto byly připraveny dotazníky, které zachycují projevy nebo obtíže, jež jsou podmíněny nebo ovlivněny ANS, jako např. the Scales for Outcomes in Parkinson’s disease – Autonomic (SCOPA-AUT), Dotazník na autonomní funkce (DAF), the Composite Autonomic Symptom Score 31 (COMPASS 31), the Autonomic Symptom Profile (ASP) nebo Survey of Autonomic Symptoms (SAS) [9– 14]. Pomocí těchto dotazníků lze rovněž odlišit některé projevy převahy aktivity subsystémů sympatiku nebo parasympatiku/ vagu.

Na rozdíl od periferního nervového systému, jehož poruchy se vyšetřují standardizovanými elektrofyziologickými postupy, postižení ANS lze detekovat mnoha metodami, které však v ČR, na rozdíl od zahraničí, nejsou dosud v klinické praxi rozšířeny [15– 21]. Dostupnost těchto vyšetření se pro neurologii výrazně zvýšila tím, že u některých EMG a EEG přístrojů lze jako doplňkové komponenty dokoupit a zařadit software umožňující registraci a vyhodnocování ukazatelů kardiálních nebo kardiovaskulárních autonomních regulací (např. Dantec-Medical [Dantec Dynamics Ltd, Royal Portbury, Velká Británie], Kubios HRV [Kubioy oy., Kuopio, Finsko], Neuro-MEP-4 [Neurosoft, Ivanovo, Rusko] a další). Základním hodnoceným ukazatelem ve vyšetřování ANS bývá srdeční frekvence (SF), která citlivě reflektuje změny činnosti sympatiku a parasympatiku (vagu). Většina onemocnění a poruch ANS bývá provázena poruchami autonomní srdeční regulace, a proto jsou tato vyšetření základním skríningem pro jejich diagnostiku. Avšak i bez speciálního přístrojového vybavení lze snadno zachytit projevy závažnějšího postižení ANS, kdy zcela základním a nejdostupnějším je měření SF. Po postavení z lehu nebo sedu (na dobu 30 nebo lépe na 60 s) se u zdravých osob zvýšené hodnoty tepové frekvence (dosažené v prvních 10 s po postavení) následně, mezi 20. a 30. s stoje vlivem aktivace vagu postupně snižují, tj. kardioakcelerace bezprostředně po postavení má být fyziologicky následována kardiodecelerací závislou na míře funkce vagu [21,22]. Ve zkoušce klinostatické, tj. po změně polohy těla ze stoje do lehu, dochází aktivací vagu ke zpomalení SF. U osob s postižením vagu se objevuje i v klidu tachykardie a i při hlubokém dýchání mizí respirační sinusová arytmie (kterou lze registrovat jak při běžném vyšetření pulzu, tak při auskultaci srdce nebo dostupných tepen). Těžší postižení sympatiku se naopak po postavení projevuje snížením hodnot krevního tlaku (TK), případně až rozvojem ortostatické hypotenze (OH).
Kardiovaskulární funkční zkoušky na autonomní regulace
K průkazu autonomních poruch se hodnotí změny SF ve funkčních zkouškách (tzv. kardiovaskulární autonomní reflexní testy), při nichž lze posuzovat především funkci vagu. V některých zkouškách se kombinuje hodnocení SF s měřením změn TK. V tab. 2. je podán stručný přehled autonomních reflexních zkoušek [22] – v citované práci jsou odkazy na publikace autorů těchto zkoušek, s jejich popisy i se způsoby hodnocení; vzhledem k rozsahu příspěvku nemohly být zařazeny do tohoto textu [22].
U osob s fyziologickou aktivitou vagu se v uvedených zkouškách objevují výrazné změny SF, kdy vagovou reflexní odpovědí je kardiodecelerace, resp. přechodná bradykardie. Naopak zvýšení SF (kardioakcelerace) je projevem snížení vagové aktivity a/ nebo zvýšení aktivity sympatiku. Ve zkouškách, v nichž se posuzují změny hodnot TK (např. v chladových testech a při izometrické kontrakci), znamená zřetelné zvýšení hodnot systolického, resp. diastolického tlaku rovněž zvýšení aktivity sympatiku. Ewing et al vypracovali baterii testů na autonomní funkce oběhového systému [23]. Ta zahrnuje hodnocení jak změn SF, tak i změn TK. SF je přitom hodnocena ve Valsalvově manévru, ortostatické zkoušce a zkoušce hlubokého dýchání. Systolický TK se měří v ortostatické zkoušce a diastolický TK při izometrické kontrakci ruky (tzv. handgrip test). Tyto zkoušky je možno provádět i bez speciálního přístrojového vybavení, postačují hodinky nebo stopky (případně jednokanálový elektrokardiograf) a tonometr. V této baterii testů se v jednotlivých zkouškách používají ukazatele změn SF a TK, které jsou uvedeny v následujícím přehledu.
Ukazatele změn srdeční frekvence a krevního tlaku v Ewingových zkouškách [22,23]
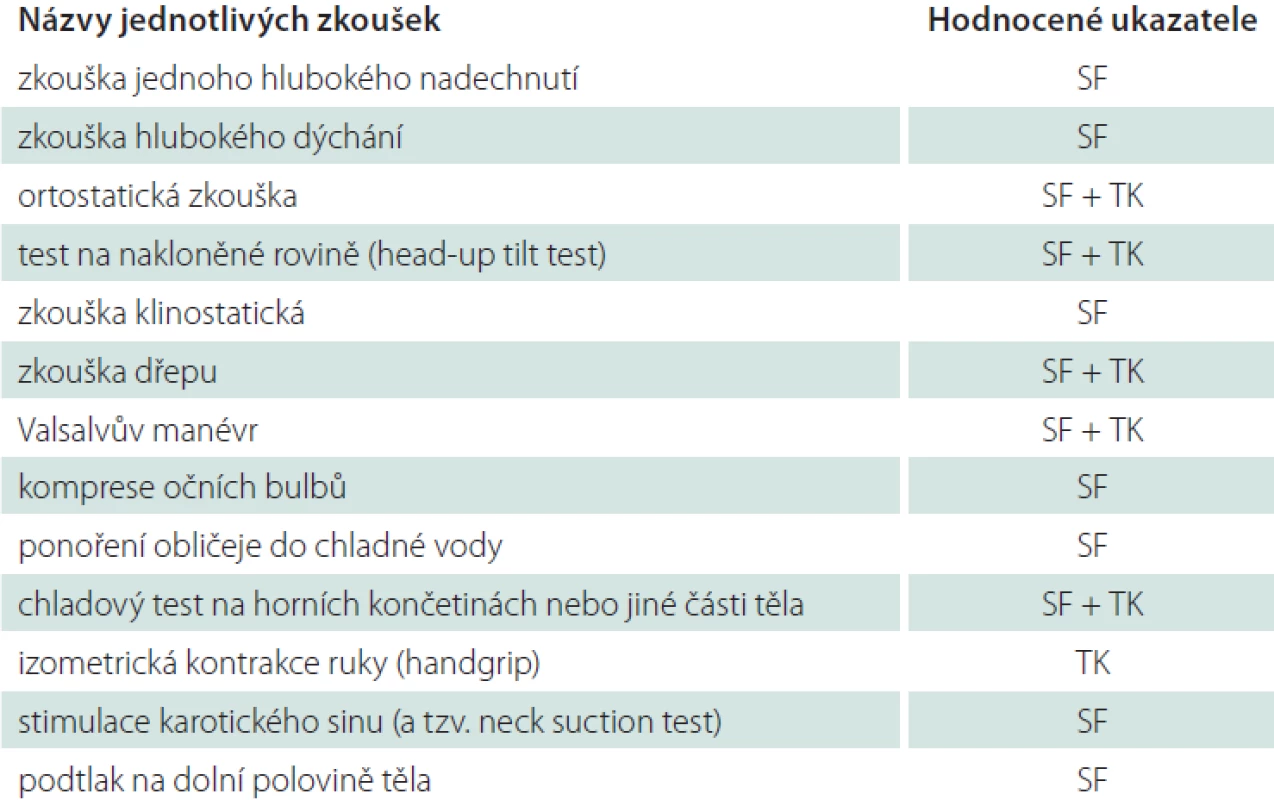
- Zkouška hlubokého dýchání – průměr rozdílů nejvyšších a nejnižších hodnot SF ze šesti (případně pouze ze čtyř) dechových cyklů (nádech/ výdech) této zkoušky. Každý z cyklů má trvat 10 s. Záznam této zkoušky u zdravého jedince je demonstrován na obr. 1, na obr. 2 je potom záznam osoby s těžkou autonomní neuropatií.
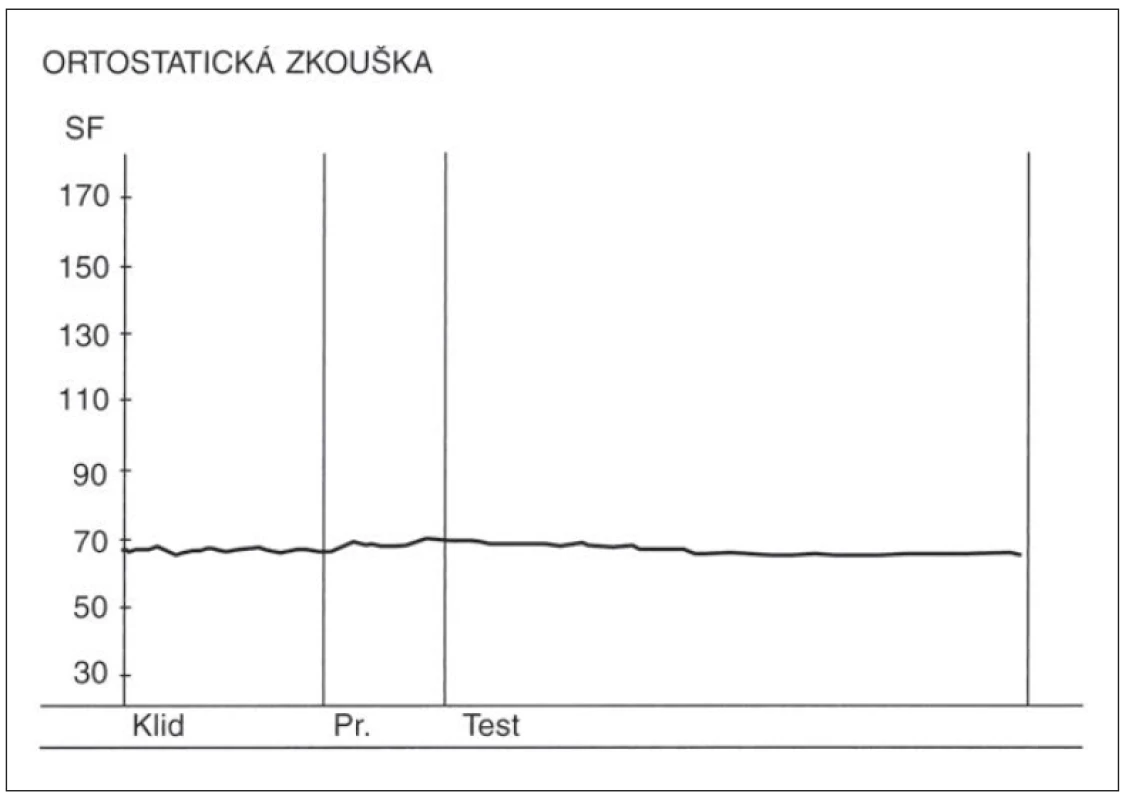
- Ortostatická zkouška – poměr 30 : 15 v této zkoušce se vypočítává jako poměr trvání nejdelšího RR intervalu kolem 30. tepu a nejkratšího RR intervalu kolem 15. tepu od začátku vstávání. (Samotný průběh změn SF v této zkoušce má výpovědní hodnotu, kdy po počáteční kardioakceleraci má následovat zřetelná kardiodecelerace.) Nálezy v této zkoušce u zdravé osoby a u pacienta s těžkou autonomní neuropatií jsou demonstrovány na obr. 3 a 4.
- Ortostatická zkouška se samotná (tj. bez hodnocení SF) využívá k průkazu OH jako projevu těžkého postižení sympatiku. Kritérii jsou snížení hodnoty systolického TK nejméně o 20 mm Hg (u pacientů s arteriální hypertenzí nebo s hypertenzními hodnotami po položení nejméně o 30 mm Hg) a snížení hodnoty diastolického TK nejméně o 10 mm Hg po 3 min klidného stoje po postavení z lehu [19,20]. Ve starších pracích [23] bylo stanoveno snížení o 30 mm Hg jako hranice pro abnormální nálezy – tab. 3.
- Valsalvův manévr – zde se k hodnocení používá Valsalvův poměr (Valsalva ratio), což je poměr nejdelšího RR intervalu krátce po skončení manévru (po výdechu proti odporu 40 mm Hg po dobu 15 s) a nejkratšího RR intervalu v průběhu tohoto výdechu. Tato zkouška se však pro náročnost, variabilitu odpovědí i pro možná rizika u některých nemocných, např. u pacientů s arteriální hypertenzí, se zvýšeným nitrolebním tlakem, nebo u pacientů s retinopatií, nedoporučuje, resp. neprovádí.
- Izometrická kontrakce ruky – v této zkoušce se při 30 % max. síly stisku ruky (handgrip test) trvajícího po dobu nejvýše 5 min posuzují změny hodnoty diastolického TK oproti klidovému stavu před zahájením zkoušky.
Fig. 1. Heart rate (SF) changes during the deep breathing test in a healthy person.
Above the x-axis – curve depicting heart rate changes during the deep breathing test.
Marked respiratory sinus arrhythmia. Y-axis – heart rate (beats per minute)
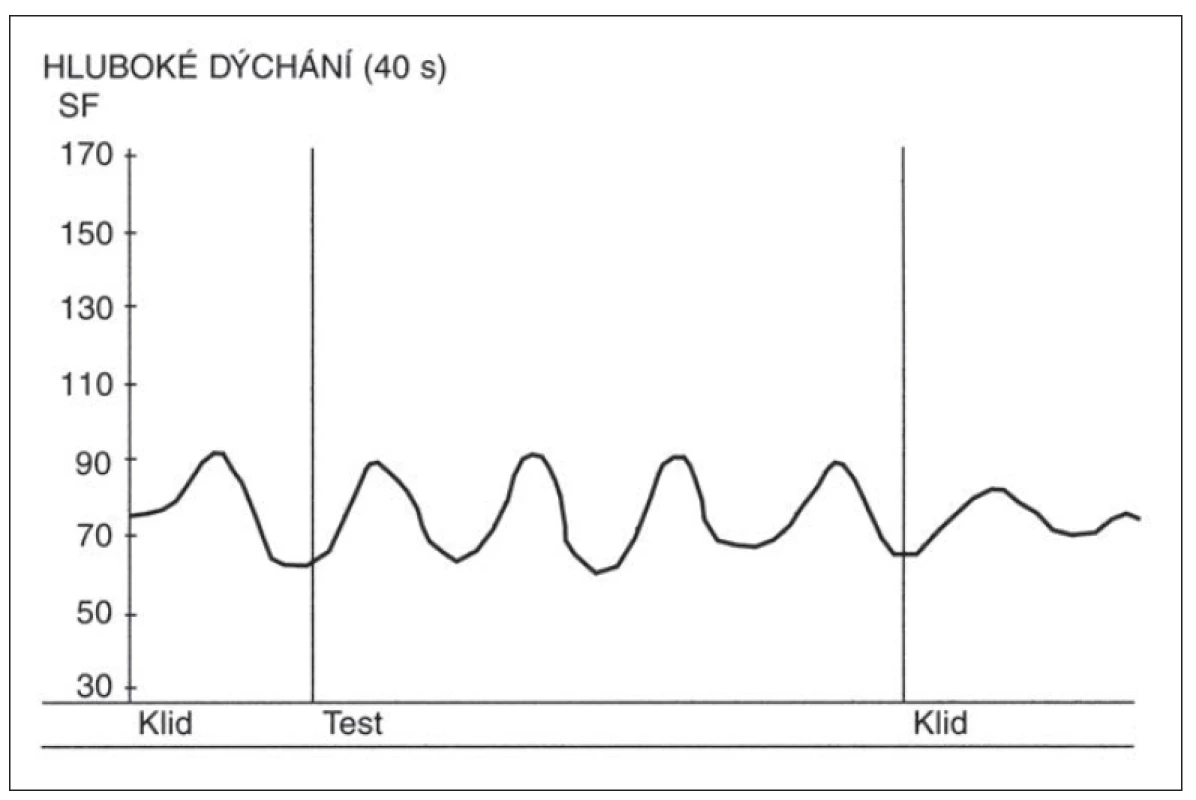
Fig. 2. Heart rate (SF) changes during the deep breathing test in a patient with severe
diabetic autonomic neuropathy.
Above the x-axis – curve depicting heart rate changes during the deep breathing test.
Absence of respiratory sinus arrhythmia. Y-axis – heart rate (beats per minute).
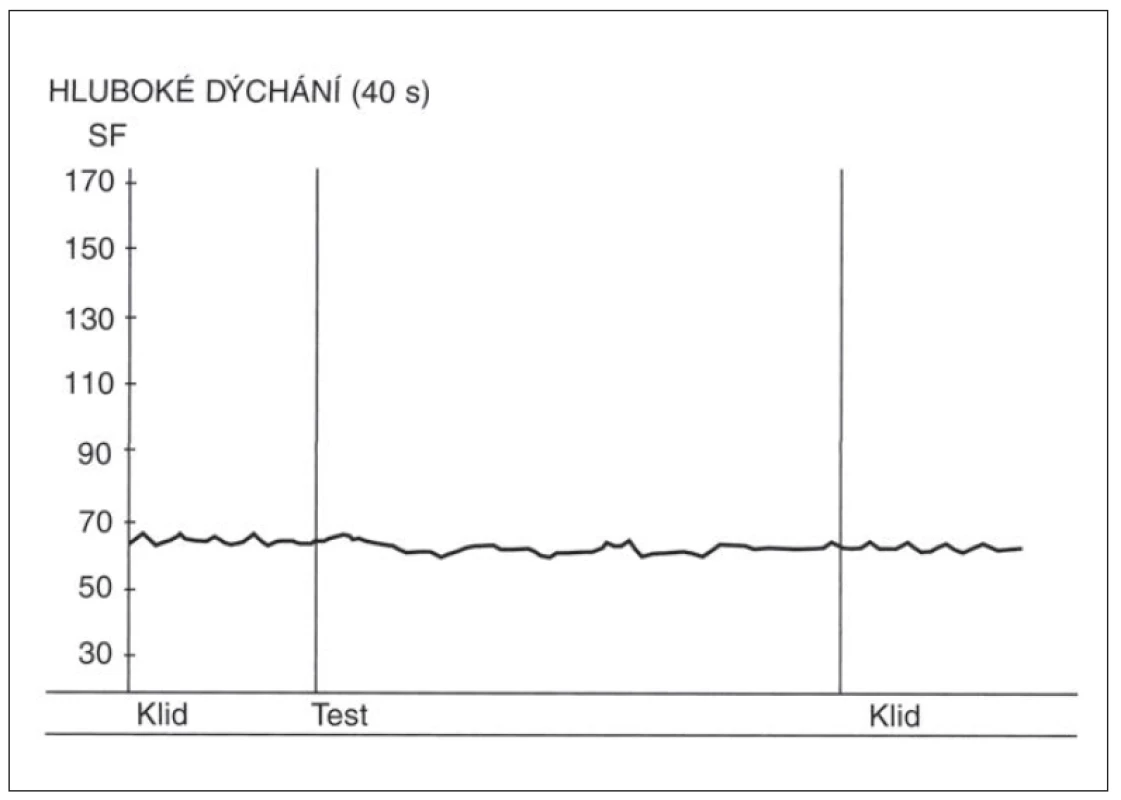
Above the x-axis – curve depicting heart rate changes during the orthostatic test. Initial
cardioacceleration followed by vagally induced cardiodeceleration. Y-axis – heart rate
(beats per minute).
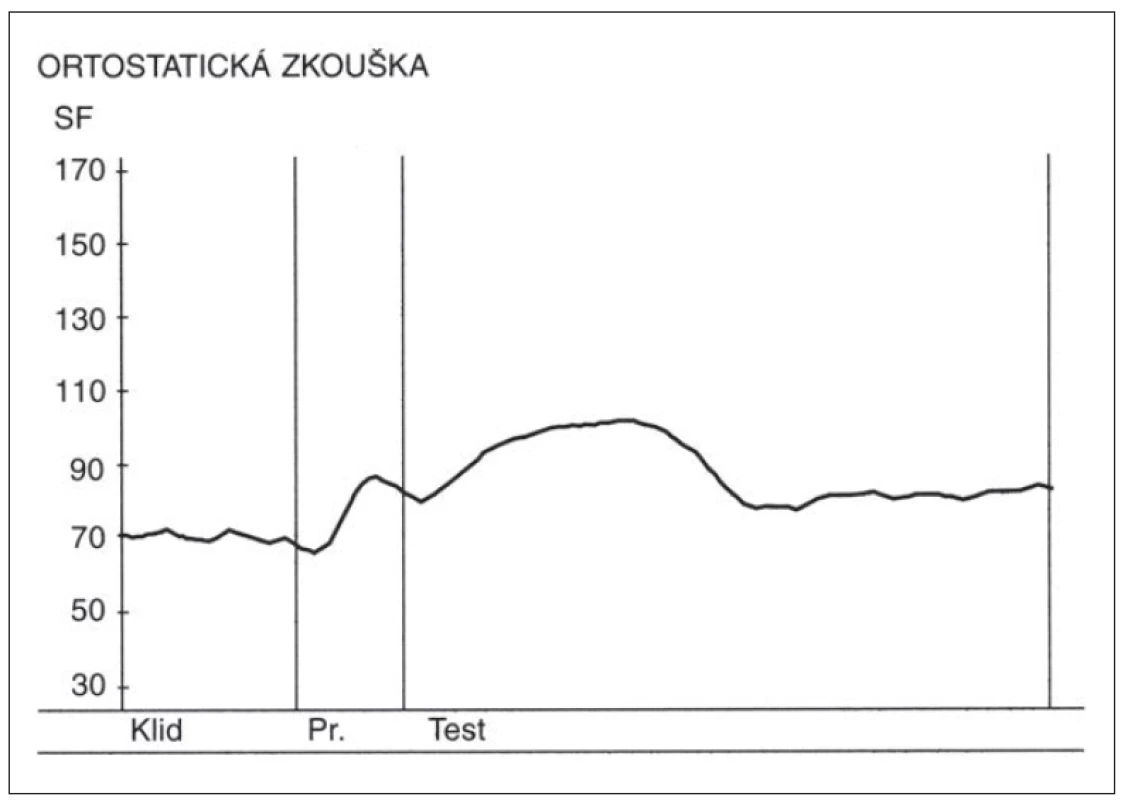
Fig. 4. Heart rate (SF) changes during the orthostatic test in a patient with severe diabetic
autonomic neuropathy.
Above the x-axis – curve depicting heart rate changes during the orthostatic test. Absence of
cardioacceleration and following cardiodeceleration. Y-axis – heart rate (beats per minute).
Původně se tato baterie reflexních autonomních zkoušek používala k diagnostice autonomní neuropatie u diabetiků, později našla uplatnění k průkazu postižení ANS u celé řady dalších onemocnění. Referenční hodnoty pro jednotlivé zkoušky jsou uvedeny v tab. 3, kde abnormální hodnoty slouží pro průkaz autonomní neuropatie.
![Referenční hodnoty ukazatelů kardiovaskulárních funkčních testů pro průkaz autonomní neuropatie (získané u pacientů
s diabetem mellitem) [23].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/fc0268c311b10a6882729572af826c1d.png)
Zjednodušené základní vyšetření kardiovaskulárních autonomních regulací
Pro základní orientaci o funkci vagu a sympatiku, ovlivňujících kardiovaskulární systém, je možné provést vyšetření pouze ve zkouškách hlubokého dýchání a ortostatické. Ve zkoušce hlubokého dýchání by měl dechový cyklus (nádech-výdech), jak již bylo uvedeno v popisu této zkoušky, trvat 10 s a měl by se opakovat nejméně 4– 6×. Při fyziologické regulační aktivitě vagu se objevují zřetelné změny SF s akcelerací při nádechu a s decelerací při výdechu. Při snížené nebo vymizelé aktivitě vagu (z jakýchkoliv příčin) jsou oscilace SF malé či vymizelé. V ortostatické zkoušce má dojít při hodnocení SF u zdravé osoby po postavení z polohy vleže do klidového stoje k iniciální kardioakceleraci, která má být následována zřetelnou kardiodecelerací, s poklesem obvykle na hodnoty o něco vyšší než před zahájením zkoušky. Při nedostatečné činnosti vagu se buď rozvíjí kardioakcelerace s následným nastavením a ustálením zvýšených hodnot tepové frekvence oproti pozici vleže, nebo se rozvíjí pomalá postupná kardioakcelerace s velmi pozdním ustálením výrazně zvýšených tepových hodnot oproti výchozím. Hodnoty ukazatelů užívaných v těchto zkouškách, získané u zdravých osob z naší populace, jsou uvedeny v monografii o ANS [10].
Ortostatická zkouška může dále současně sloužit i k posouzení funkce sympatiku, konkrétně jeho insuficience, kde jejím projevem je OH. Porovnávají se hodnoty TK vleže a potom po třech minutách klidného stoje. Kritéria byla uvedena výše [19,20]. U tohoto maximálně zjednodušeného vyšetření není pro posuzování změn SF potřebná ani přesná kvantifikace získaných hodnot. Pro základní orientaci postačuje vizuální zhodnocení tepových křivek kardiotachogramu v těchto dvou zkouškách.
Vedle těchto kardiovaskulárních reflexních zkoušek se hodnotí (v již rozšířeném vyšetření ANS) variabilita SF (VSF) v oblastech (doménách) časové a frekvenční. Starší způsob je hodnocení v časové oblasti, kde se používají číselné charakteristiky a indexy, jako např.:
- SDNN – směrodatná odchylka z posloupnosti všech normálních intervalů (NN) záznamu (v ms);
- SDANN – směrodatná odchylka průměrných hodnot NN intervalů vypočítaných z pětiminutových úseků záznamu (v ms);
- pNN50 – podíl zastoupení počtu sousedních NN intervalů lišících se o více než 50 ms z celkového počtu NN intervalů v průběhu záznamu (v procentech).
Vedle nich se používají i tzv. geometrické metody, kam patří např. triangulární index. Definice a způsoby výpočtu těchto a dalších užívaných charakteristik a indexů jsou popsány v metodikách vyšetřování ANS, resp. VSF [22,24,25].
Citlivějším vyšetřením zachycujícím nepřímo zejména dechově vázanou aktivitu vagu je spektrální analýza VSF (SAVSF), která informuje současně o aktivitě vagu i sympatiku (v závislosti na situaci, nejčastěji poloze těla) a orientačně i o poměru jejich aktivit [22,24,25].
Hodnocení variability srdeční frekvence
Variabilita srdeční frekvence se hodnotí, jak již bylo uvedeno výše, v tzv. časové oblasti (time domain) nebo ve frekvenční oblasti (frequency domain) [25,26]. Metodické postupy, způsoby hodnocení a jejich aplikace v klinické praxi jsou popsány v přehledových pracích [22,24]. Aktivitu vagu a jeho změny v různých situacích a u různých diagnóz lépe zachycuje hodnocení VSF ve frekvenční oblasti. Proto bude v následujícím textu podrobněji přiblížena. Principem tohoto postupu je skutečnost, že ukazatele kardiovaskulárních funkcí (SF i hodnoty TK) oscilují současně v několika rytmech. Proto lze VSF posuzovat ve zmíněné frekvenční oblasti a metoda se označuje jako spektrální analýza VSF (SAVSF). Celé frekvenční spektrum VSF lze rozdělit do několika frekvenčních složek (pásem, komponent), z nichž každá má svůj odlišný fyziologický základ. K získání hodnot ukazatelů SAVSF se užívají nejčastěji dva postupy – tzv. rychlá Fourierova transformace (fast Fourier transformation) nebo autoregresivní model. Základní rozdíl mezi nimi spočívá v tom, že u rychlých Fourierových transformací se vyžaduje přísná periodicita sledovaných rytmů, a s tím souvisí i předem stanovený počet a rozmezí frekvenčních pásem, zatímco autoregresivní model sám stanovuje počet a centra jednotlivých frekvenčních složek. Záznamy mohou být krátkodobé (řádově trvající od desítek s po řadu min) a dlouhodobé, jež trvají řádově hodiny.
Ve většině prací se z rozmezí frekvenčního spektra hodnotí pouze ukazatele složky nízkofrekvenční (0,05– 0,15 Hz) a vysokofrekvenční (0,15– 0,40 Hz). V dlouhodobých záznamech lze posuzovat i tzv. velmi nízké a ultranízké frekvence. U SAVSF lze hodnotit několik ukazatelů. Za nejvýznamnější se považují spektrální výkony jednotlivých frekvenčních komponent, které se vyjadřují v ms2 a lze je přiblížit jako „plochu“ spektrální složky. Vedle toho se též používá výkonová spektrální hustota (power spectral density) vyjadřovaná v ms2/ Hz. Výkonovou spektrální hustotu si je možno představit jako „výšku“ nebo „amplitudu“ spektrální komponenty. Dále se vyjadřuje relativní zastoupení jednotlivých spektrálních složek (vyjadřuje se v tzv. normalizovaných jednotkách) a poměry jejich spektrálních výkonů. Autonomní reaktivita se registruje nejlépe v situacích, kdy dochází k reflexní aktivaci jak sympatiku, tak i vagu. Při hodnocení SAVSF se proto používá např. zkouška leh-stoj-leh (ortoklinostatická zkouška), kdy se po postavení zvyšuje aktivita sympatiku a výrazně snižuje aktivita vagu a po opětovném položení (klinostatická část zkoušky) se naopak redukuje aktivita sympatiku a zesiluje činnost vagu [27]. Tyto změny se zobrazují jako vrcholy různé výšky v jednotlivých fázích této zkoušky. Mladé zdravé osoby mají jednotlivé frekvenční složky zřetelné s dynamickými změnami v jednotlivých fázích zkoušky, zatímco u osob starých nebo u postižení ANS se jejich amplituda zřetelně snižuje, až případně mizí. U neurologických diagnóz byla zachycena řada abnormit VSF, které mají nejen diagnostický, ale i prognostický význam. U získaných nálezů je však nutno respektovat interindividuální variabilitu a věkové odlišnosti. Pro ilustraci jsou uvedeny na obr. 5– 7 grafické záznamy od zdravé osoby a od dvou nemocných s různou tíží postižení ANS [22].
Fig. 5. Spectral analysis of heart rate variability
in a healthy person in a short-
-term record ing in the supine-standing-
-supine test.
X-axis – frequency range 0.01– 0.5 Hz.
Y-axis – amplitude (power spectrum density).
Z-axis – time course of the test with
diff erent body positions (T1, T2 and T3).
High frequency spectral component
(represent ing vagal activity – here it is
around 0.22 Hz) is evident in supine body
positions (T1 and T3) and mis s ing in a phase
of stand ing (T2).
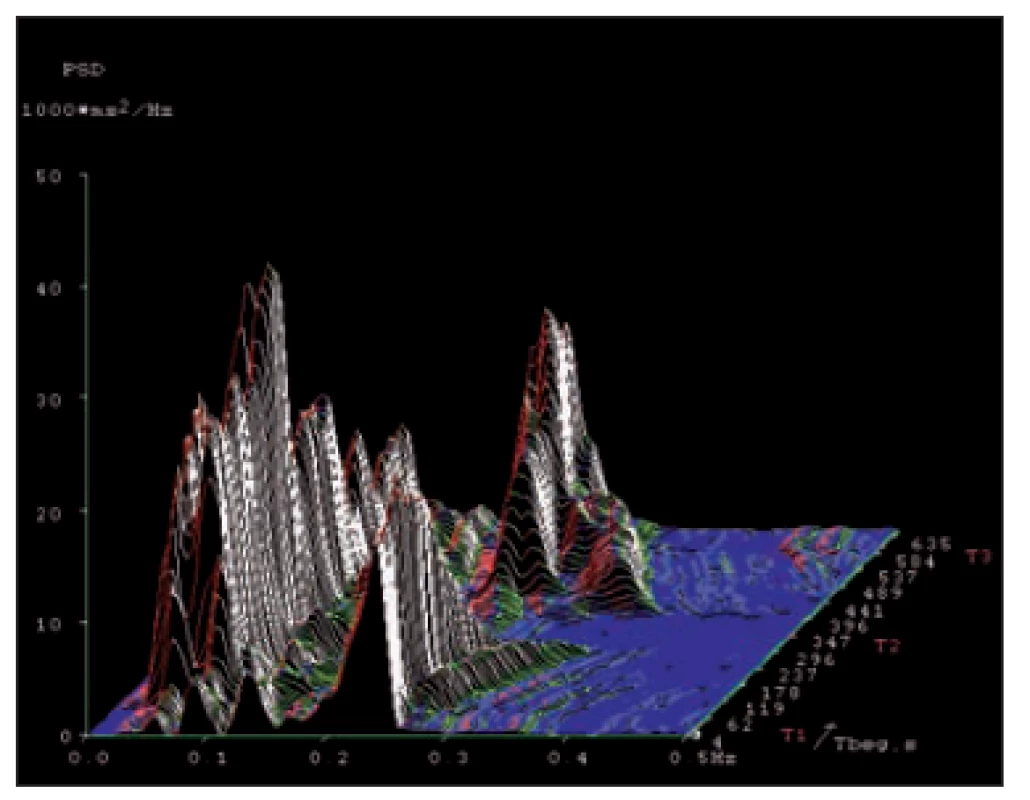
Fig. 6. Spectral analysis of heart rate variability
in a patient with autonomic neuropathy
with predominant vagal impairment
in a short-term record ing in the
supine– standing– supine test.
X-axis – frequency range 0.01– 0.5 Hz. Y-axis –
amplitude (power spectrum density). Z-axis –
time course of the test with diff erent body
positions (T1, T2 and T3). An evident decrease
of the high frequency spectral component
(0.15– 0.40 Hz) represent ing respiratory
bounded vagal activity. A typical fi nd ing for
vagal insuffi ciency in autonomic neuropathy.
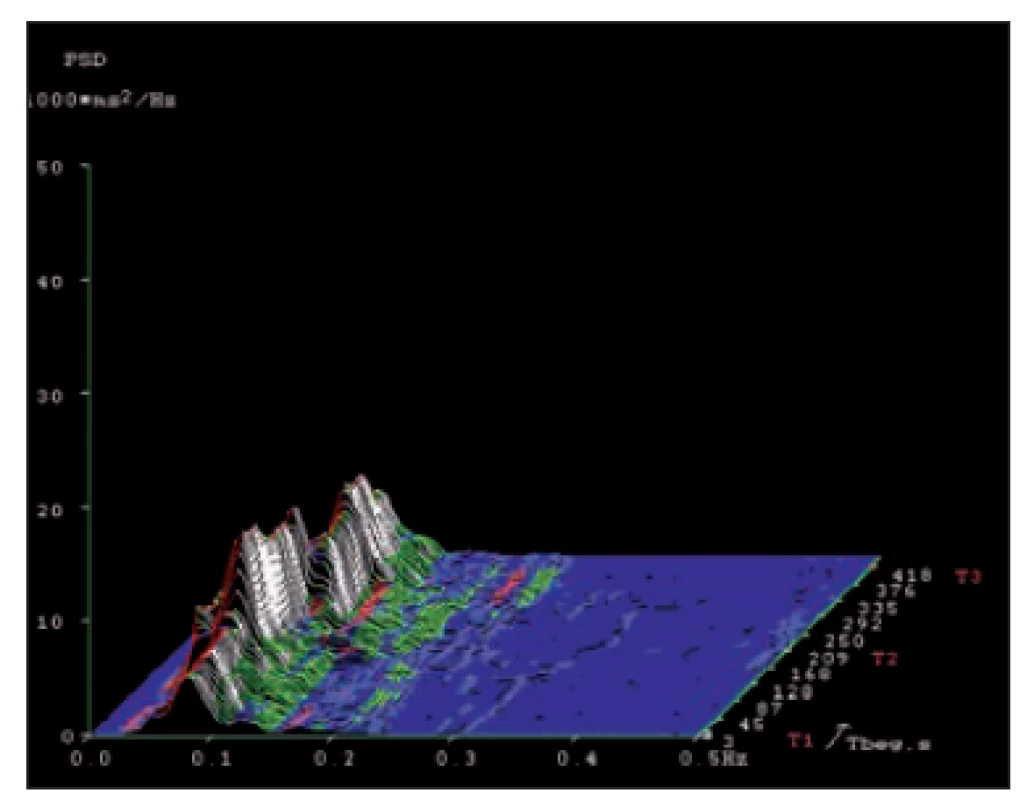
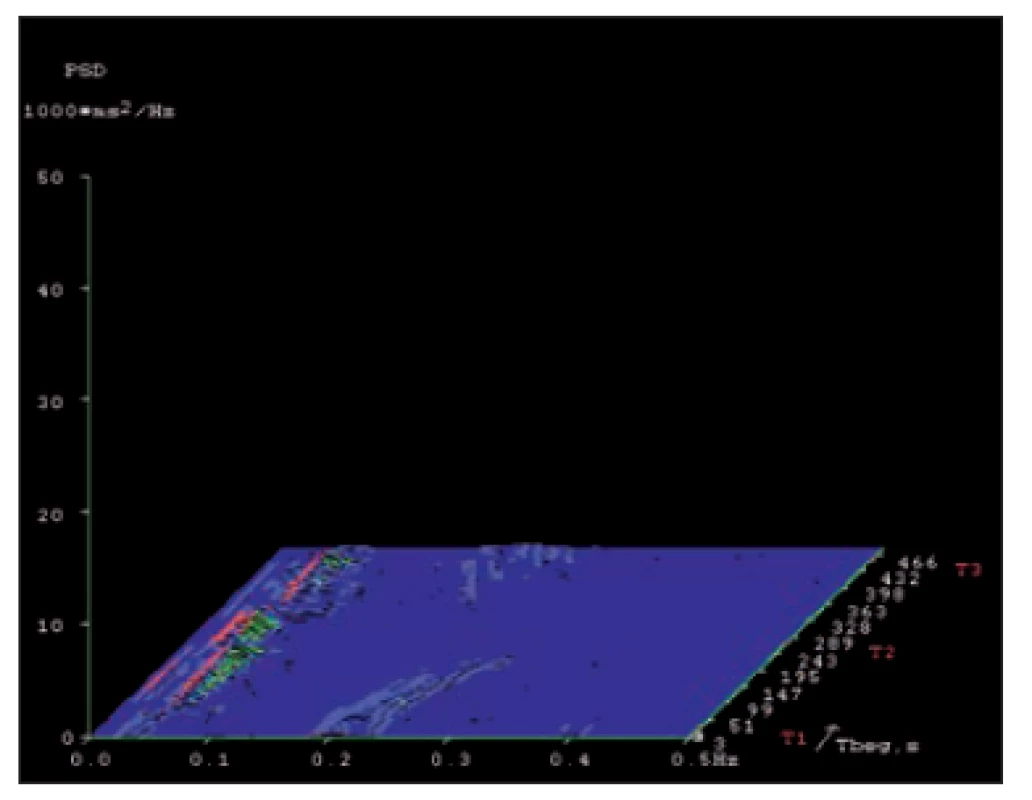
Fig. 7. Spectral analysis of heart rate variability
in a patient with severe autonomic
neuropathy in a short-term record ing in
the supine– standing– supine test.
X-axis – frequency range 0.01– 0.5 Hz. Y-
-axis – amplitude (power spectrum density).
Z-axis – time course of the test with diff erent
body positions (T1, T2 and T3). A mark -
ed decrease of power of both spectral
components (low frequency 0.04– 0.15 Hz
and high frequency 0.15– 0.4 Hz). Practical
absence of the high frequency spectral
component.
Vedle časové a frekvenční analýzy se pro hodnocení VSF využívají i metody nelineární dynamiky [28,29], které se však jeví jako náročné pro klinickou praxi a jejich výsledky se objevují častěji ve výzkumných pracích.
Další metody vyšetřování autonomních funkcí a poruch v kardiovaskulárním systému
Vedle uvedených metod se používají i metody vyžadující speciální přístrojové vybavení.
Mezi ně patří hodnocení citlivosti baroreflexu se souběžnou kontinuální registrací SF a TK, které podává významnou informaci o autonomních regulacích v oběhovém systému [30– 32].
Poruchy adrenergní inervace myokardu lze prokazovat specifickými radionuklidovými zobrazovacími metodami, v nichž se aplikují nemetabolizovatelná analoga noradrenalinu – 123I-metaiodobenzylguanidin (123I-MIBG), 18F-dopamin nebo sympatomimetický amin 11C-hydroxyefedrin (a další příbuzné látky) – a stanovuje se míra obratu noradrenalinu v myokardu [33,34]. Poruchy adrenergní inervace periferních cév je možno rovněž prokazovat scintigraficky po aplikaci 123I-MIBG, kde se hodnotí zpětné vychytávání (uptake) této látky.
Přestože jsou u postižení ANS časté poruchy cévních reakcí, vyšetření vazomotoriky jsou prováděna pouze zřídka. Dávají informaci o stavu vláken sympatiku inervujících končetinové cévy. K těmto vyšetřením se často využívá flowmetrie na Dopplerově principu [35,36]. K posouzení cévní reaktivity lze využít farmakologické testy s látkami s vazokonstrikčními nebo vazodilatačními účinky. Ve specifických situacích je přínosné termografické vyšetření, které se např. uplatňuje v hodnocení a monitorování stavu u komplexního regionálního bolestivého syndromu (KRBS) typu I (dříve označovaného též jako algodystrofie, algoneurodystrofie nebo reflexní sympatická dystrofie).
Vyšetřovací metody autonomních funkcí a poruch v dalších systémech organizmu
Poruchy autonomní regulace v dalších systémech organizmu se vyšetřují vesměs metodami užívanými v jednotlivých medicínských oborech, tj. např. v gastroenterologii, urologii, oftalmologii, resp. speciálními metodami pro vyšetřování autonomních funkcí. Na rozdíl od zkoušek na kardiovaskulární autonomní regulace a na baroreflexní senzitivitu nebyly pro další systémy vypracovány standardizované vyšetřovací postupy a nebyly ujednoceny metodiky. Proto tato vyšetření nepatří do základního vyšetřovacího schématu pro funkce ANS. Zatímco abnormální reflexní odpovědi prokázané v kardiovaskulárním systému manifestují s velkou pravděpodobností difuznější nebo generalizované postižení ANS, poruchy zjištěné v jednotlivých systémech či poruchy jednotlivých funkcí mohou preferenčně nebo izolovaně postihovat jeden konkrétní systém. Přesto tyto nálezy mohou být významným přínosem pro diagnostiku i terapii u nemocných s neurologickými diagnózami.
V gastrointestinálním systému se hodnotí především rychlost pasáže v jednotlivých úsecích. V oblasti dolní části ezofagu je možno posuzovat autonomní funkce metodami manometrickými (obdobně i v oblasti anorektální), dynamickou scintigrafií a též ezofageálními evokovanými potenciály. K posuzování rychlosti evakuace žaludku a rychlosti pasáže v jednotlivých úsecích střev se využívají radiografické, kinematografické (s podáním kontrastních látek) a scintigrafické vyšetřovací metody. Činnost žaludku a stav jeho autonomních struktur je možno posuzovat i pomocí sonografie, elektrogastrografie a magnetogastrografie. V terminálním úseku gastrointestinálního traktu (GIT) se autonomní dysfunkce manifestují poruchou análního sfinkteru, tj. inkontinencí stolice. Tyto poruchy se dají diagnostikovat anorektální manometrií, elektromyografií hladkého svalstva, vyšetřením sakrálních reflexů, případně pomocí análních evokovaných potenciálů [37,38].
Autonomní dysfunkce v močopohlavním systému se posuzují nejčastěji podle odpovědí močového měchýře ve funkčních zkouškách. Jejich klinickým korelátem jsou mikční poruchy, kdy však citlivá vyšetření mohou zachytit již časné fáze subklinického postižení ANS. Postižení měchýře se může projevovat změnami kapacity, poruchami evakuace, případně kombinací poruch, jako např. dyssynergií detruzorově-sfinkterickou. K vyšetřením se využívají urodynamické metody, jako jsou uroflowmetrie, cystometrie a elektromyografie, a dále cystouretrografie, farmakocystosfinkteromanometrie, případně i další. Většinu těchto vyšetření provádějí urologové.
Poruchy pohlavních funkcí se u mužů s poruchami ANS vyšetřují falopletysmograficky nebo podle latence bulbokavernózního reflexu, kdy bulbokavernozní a pudendální reflexy se rovněř hodnotí i u poruch kontinence a postižení inervace pánevního dna. Obdobně je možno hodnotit pudendální evokované potenciály a sakrální evokované odpovědi [39].
Vyšetřování sudomotoriky (pocení) [40,41] se provádí přímo látkami, které při pocení zbarvují povrch kůže vyšetřované oblasti. Z klasických testů sem patří potní testy s použitím škrobu s jódem, ninhydrinu, 1,4-dihydroxyantrachinonu (chinizarinu) nebo kobaltové modři. K nepřímému hodnocení sudomotoriky se používají komůrkové sudorimetry ke stanovení změn vlhkosti na prstech horní končetiny.
Ve farmakologických zkouškách se aplikuje acetylcholin nebo pilokarpin. Pilokarpin svým postgangliovým účinkem testuje přímo funkci potních žláz. Míra pocení se posuzuje potním otiskem (sweat imprint) zachycujícím i hustotu potních žláz nebo evaporimetricky. V současné době se při vyšetřeních ANS při podezření na poruchy pocení doporučuje provádět kvantitativní sudomotorický test (kvantitativní sudomotorický axonální reflexní test; QSART), při němž je iontoforeticky aplikován acetylcholin. Získává se tak informace o stavu postgangliových sudomotorických axonů sympatiku. Toto vyšetření však vyžaduje speciální vybavení. Doplnění QSART termoregulačním potním testem přispívá k odlišení pregangliových od postgangliových postižení.
Jiná možnost, jak hodnotit sudomotorické funkce, je využití změn elektrických vlastností kůže při pocení. Dříve se pro tato vyšetření používalo označení psychogalvanický reflex, nyní se přednostně užívá termín elektrodermální aktivita. Při vyšetřeních ANS je neurology využíváno hodnocení sympatické kožní odpovědi (sympathetic skin response; SSR) [42].
Tato metodika je dostupná v elektrofyziologické laboratoři a může sloužit k doplnění nálezů z kardiovaskulárních funkčních zkoušek nebo SAVSF v diagnostice autonomních poruch, přestože odpovědi lze hodnotit spíše kvalitativně než kvantitativně. Novější metodou využívanou nyní v zahraničí častěji k hodnocení sudomotoriky (a postižení tenkých nervových kožních vláken) je měření elektrochemické vodivosti kůže a koncentrace chloridových iontů (Sudoscan) [43,44].
Abnormální zornicové reakce mohou odhalit lokalizovanou poruchu ANS, resp. kraniální postižení v rámci difúznějšího či generalizovaného postižení ANS [45,46]. Mióza je podmíněna aktivitou parasympatických vláken jdoucích cestou nervi oculomotorii, zatímco mydriáza aktivitou sympatických vláken vycházejících z centrum ciliospinale v míše. Používají se vyšetřovací postupy hodnotící reakci na osvit (statická a dynamická pupilometrie) a farmakologické zkoušky s aplikací látek ovlivňujících oční vlákna sympatiku nebo parasympatiku [47]. Zejména dynamická pupilometrická vyšetření na specializovaných pracovištích oftalmologů mohou rozšířit spektrum vyšetření k průkazu autonomních poruch [48].
Přímé vyšetřování aktivity ve svalových nebo kožních vláknech sympatiku lze provádět intraneurálně tzv. mikroneurografickou metodou wolframovými mikroelektrodami.
Mikroneurografické vyšetření dává ojedinělou možnost přímého vyšetření aktivity ve vláknech sympatiku [49– 51]. Limitujícími faktory jejich širšího využití v klinické praxi jsou invazivnost, metodická a časová náročnost.
Z dalších náročnějších metod k průkazu neuropatií s postižením ANS (a současně i postižení tenkých senzitivních vláken – proto není pro ANS specifická) můžeme použít hodnocení hustoty tenkých intraepidermálních vláken z kožní biop-sie imunohistochemicky nebo nepřímou imunofluorescencí [52– 54].
Biochemická vyšetření autonomního nervového systému
Biochemická vyšetření patřila po dlouhou dobu mezi postupy, jimiž byl posuzován stav ANS. Podrobněji byla vypracována schémata k posuzování aktivity sympatiku. Hodnotí se plazmatické hladiny katecholaminů, kdy zvýšenou citlivost přinesly metody chromatografické a radioenzymatické, jež umožňují odlišení odpovědí i na různé druhy podnětů a tzv. vegetotropní farmaka [55,56]. Ve srovnání s prostým stanovováním hladin katecholaminů v plazmě se nyní považují za citlivější kinetické metody určující metabolický obrat noradrenalinu, vč. rozdílů mezi jednotlivými studovanými orgány.
Farmakologické zkoušky na reaktivitu ANS
Používají se vegetotropní farmaka, kdy se studují odpovědi SF (po aplikaci isoprenalinu) a TK (po aplikaci noradrenalinu, fenylefrinu a tyraminu). Průkazem hypersenzitivity receptorů sympatiku jsou nadměrné reakce ve smyslu abnormální tachykardie po isoprenalinu nebo excesivní presorické reakce po látkách s vazokonstrikčními účinky [57,58]. V cholinergním systému se k průkazu hypersenzitivity podávají agonisté muskarinových receptorů (např. pilokarpin u vyšetření zornicových reakcí).
Popsané biochemické a farmakologické metody nejsou i přes vysokou citlivost vhodným markerem celkového stavu ANS, ani nejsou běžně dostupné v rutinní klinické praxi. Proto se v současnosti používají pouze na vysoce specializovaných pracovištích.
Nemoci a poruchy autonomního nervového systému v neurologii
Okruh onemocnění a dysfunkcí ANS v neurologii je velmi široký. Proto budou v této kapitole uvedeny ve stručném přehledu diagnózy a stavy, s nimiž se neurolog ve své praxi může setkat a v jejichž diagnostice a terapii mu přísluší významná úloha.
Pro přehlednost lze tyto stavy rozdělit na závažnější postižení periferního ANS a na převažující postižení centrálního ANS. U některých stavů, jak bude dále uvedeno, dochází k postižení obou těchto součástí ANS.
Vedle tohoto dělení se autonomní dysfunkce rozlišují na generalizované a lokalizované.
Generalizovaná nebo též systémová autonomní postižení budou popsána podrobněji.
Z lokalizovaných autonomních poruch uvádíme jako vybrané příklady – Hornerův syndrom (mióza, parciální ptóza a podle některých autorů i lehký enoftalmus), Adieho syndrom, KRBS typu I (dříve též známý jako algodystrofický syndrom, reflexní sympatická dystrofie, Sudeckův syndrom), syndrom krokodýlích slz (Bogoradův syndrom) a harlekýnský syndrom.
V této kapitole bude hlavní pozornost zaměřena na klinické obrazy, které mají napomoci k rozpoznání a diagnostice onemocnění a poruch ANS. Její obsah má poskytnout neurologům rámcový přehled o symptomatologii v oblasti autonomních poruch. S ohledem na rozsah kapitoly nebudou uváděna speciální paraklinická vyšetření ani terapie pro jednotlivé diagnózy a stavy.
Postižení periferního autonomního nervového systému
Tato rozsáhlá skupina etiologicky a patofyziologicky odlišných postižení periferního ANS zahrnuje tzv. periferní autonomní neuropatie (AN). Podle anglické terminologie, při klinicky významných obtížích, jsou též označovány jako periferní autonomní selhání. Nemají se již používat starší názvy jako např. vegetativní nebo viscerální neuropatie. Do okruhu těchto onemocnění a poruch se zařazují podle etiologie – hereditární AN, metabolicky podmíněné AN – diabetická AN (DAN), AN při chronickém selhání ledvin, při chronických jaterních onemocněních a autonomní postižení u amyloidózy, autoimunitně podmíněné AN – autoimunitní autonomní gangliopatie, u autoimunitních systémových onemocnění a je možno sem přiřadit i autonomní postižení v rámci Guillain-Barrého syndromu, dysautonomie při infekcích (z nichž je ve světě zřejmě nejznámější Chagasova nemoc), paraneoplastické AN, lékově a toxicky vyvolané autonomní dysfunkce a konečně skupina označovaná jako čisté autonomní selhání (pure autonomic failure).
Toto členění je pouze rámcové a není zcela přesně vymezující, protože některá postižení ANS lze zařadit do více z uvedených etiologických skupin a některé z uvedených diagnóz se mohou, zejména v průběhu času, i překrývat.
Charakteristiky nemocí a postižení periferního autonomního nervového systému
Hereditární autonomní neuropatie
Do této skupiny patří hereditární senzitivní a AN (HSAN), které se dělí do pěti skupin [59].
U onemocnění označeného jako typ HSAN I se udává způsob dědičnosti autozomálně dominantní, nebo geneticky heterogenní. Klinické příznaky se objevují od druhé dekády života. Ze senzitivních příznaků se zjišťují poruchy termocepce a nocicepce. Z autonomních projevů je charakteristická hypo - až anhidróza, u části nemocných kardiovagální poruchy. Při progresi onemocnění se objevují hlavně na akrech končetin trofické vředy.
U typu HSAN II je způsob dědičnosti autozomálně recesivní (byl zjištěn rovněž i sporadický výskyt) s rozvojem symptomatiky v časném dětství. Významné autonomní poruchy jsou hypo - nebo anhidróza. Zřejmě v souvislosti s nimi se objevují febrilní stavy. U nemocných bývají přítomny trofické poruchy na končetinách a poruchy zornicových reakcí. Z gastrointestinálních autonomních symptomů se objevují dysfagie a zácpa. Při neurologickém vyšetření lze prokázat poruchy termocepce, nocicepce a propriocepce.
Typ HSAN III je rovněž znám pod označením familiární dysautonomie nebo Riley--Dayův syndrom a objevuje se s nejvyšší četností v populaci aškenázských Židů. Způsob dědičnosti je autozomálně recesivní. Histologicky bylo zjišteno snížení počtu pregangliových neuronů v intermediolaterálních míšních jádrech (sloupcích) a změny sympatických ganglií v krční a hrudní oblasti. Míšní změny mohou postihovat i spinotalamický trakt, spinocerebelární dráhy a zadní provazce. Proto může být při klinickém vyšetření napínacích reflexů zjištěna hypo - až areflexie, resp. ataxie. Autonomní dysfunkce u tohoto typu neuropatie postihují několik systémů organizmu. V oběhovém systému to bývá OH, přestože se mohou objevovat i hypertenzní krize. Ze sudomotorických poruch bývá přítomno občasné výrazné pocení. Časté jsou u těchto pacientů rovněž gastrointestinální poruchy jako gastroezofageální reflux, dysfagie a poruchy motility jícnu a žaludku. Nápadné je snížení slzení a poruchy citlivosti rohovky. Specifickým znakem je vymizení fungiformních papil na jazyku, což napomáhá ke správnému stanovení diagnózy. Ze senzitivních poruch je součástí klinického obrazu porucha termického čití a porucha vnímání bolestivých podnětů až ztráta nocicepce [60].
Nemocní s typem HSAN IV mívají výrazně snížené pocení, poruchy termoregulace (objevují se horečky) a vymizení kožní reakce sympatiku. Ze senzitivních poruch je nápadná porucha vnímání bolestivých podnětů. Proto se také onemocnění synonymicky označuje jako „kongenitální necitlivost na bolestivé podněty s anhidrózou“. Histologicky se zjišťuje úbytek nemyelinizovaných nebo málo myelinizovaných vláken. U těchto nemocných bývá přítomna retardace motorického a psychického vývoje. Způsob dědičnosti je autozomálně recesivní.
U nemocných se vzácně se vyskytujícím typem HSAN V lze prokázat poruchy vnímání tepla a bolestivých podnětů. Z dysautonomních příznaků se u nich objevují poruchy pocení a trofické poruchy. Senzorický deficit vede u nich již v dětství k četným poraněním a poškozením na akrech končetin [59,61].
Autonomní dysfunkce je možné z příbuzných hereditárních onemocnění prokázat nejen u HSAN, ale také někdy i u hereditární motorické a senzitivní neuropatie, jmenovitě u nemoci Charcot-Marie-Tooth (hereditární motorická a senzitivní neuropatie I a II). U části těchto nemocných lze totiž zachytit vedle postižení periferního nervového systému (somatického) s obrnami a poruchami čití též nepříliš závažné autonomní abnormality z postižení parasympatiku a sympatiku jako poruchy zornicových reakcí a poruchy pocení na akrech končetin. Pouze u menšího počtu z nich se objevují i oběhové poruchy, a to SF, TK a také změny vazomotorických reakcí [59].
Do skupiny hereditárních onemocnění s recesivní dědičností vázanou na chromozom X a s autonomními poruchami patří Fabryho choroba (angiokeratoma corporis diffusum), u níž se prokazuje defekt enzymu α-galaktosidázy, což vede ke střádání glykosfingolipidů. Klinicky se projevuje nápadným výsevem mnohočetných kožních angiokeratomů, hypertrofickou kardiomyopatií a projevy postižení dalších orgánů. Neurologická symptomatika zahrnuje postižení periferního (akroparestezie a kruté záchvatovité bolesti na akrech) a ANS – hypohidróza až anhidróza, gastrointestinální příznaky, poruchy lakrimace, salivace a termoregulace. V dospělosti je u pacientů s touto chorobou vysoká četnost výskytu CMP [61].
Metabolicky podmíněné autonomní neuropatie
Diabetická autonomní neuropatie je nejčastější postižení ANS v naší populaci.
U jednotlivých nemocných je obraz autonomních dysfunkcí polymorfní podle dominantního postižení různých orgánů nebo systémů. Nejfrekventovanější bývá tzv. kardiovaskulární AN.
Prevalence AN u pacientů s diabetem mellitem (DM) je podle různých autorů v rozmezí 15– 31 %. Může být přítomna již v době průkazu onemocnění, charakteristický je ale ve většině případů její zvyšující se výskyt v závislosti na trvání DM. Četnost subklinických forem, jež jsou prokazatelné vyšetřeními ANS, je mnohem vyšší než četnost klinicky manifestovaných DAN, které již svědčí o pokročilém postižení ANS. Ve většině případů se jako první objevuje postižení vagu (parasympatiku), obvykle až později se přidružuje postižení sympatiku.
Průkaz DAN je známkou výrazně zvýšeného rizika mortality během několika let. Mortalita nemocných s klinicky manifestní DAN dosahuje do deseti let 20– 50 %.
S přihlédnutím k frekvenci výskytu DAN v naší populaci a ke klinické podobnosti jejich příznaků se symptomy u dalších jiných autonomních neuropatií bude symptomatika DAN popsána dostatečně podrobně, aby charakteristiky autonomních dysfunkcí nemusely být popisovány opakovaně u dalších onemocnění s AN.
Klinická symptomatika a nálezy u diabetické autonomní neuropatie
Obrazy postižení ANS mohou být u DM velmi pestré. Ve většině případů se nejedná o postižení monosystémové, nýbrž většinou je postižen ANS inervující různé systémy, avšak jejich manifestace je odlišná [22,62– 64]. V recentní literatuře se dysfunkce rozčleňují na kardiovaskulární, gastrointestinální, močopohlavní, sudomotorické a oční (zornicové).
Nejen nejčastěji, ale ve většině případů i nejčasněji se u pacientů s DM zjišťuje postižení kardiovaskulárního systému označované jako kardiovaskulární AN. Kardiovaskulární systém slouží jako základní monitor postižení ANS, neboť míra postižení, resp. dysfunkce ANS, je zde časně detekovatelná, navíc však i kvantifikovatelná. Průkaz autonomní dysfunkce nebo neuropatie v oběhovém systému má mimořádný význam, protože je významným prediktorem mortality.
Projevem DAN je snížení respirační sinusové arytmie, která se objevuje již při klidném dýchání, nápadněji pak při hlubokém dýchání. Dalším markerem AN je snížení variability SF i při klidném dýchání [22].
Kardiovaskulární AN se rovněž projevuje výrazným snížením reflexně vyvolaných změn SF v dalších situacích nebo zkouškách (jako např. ve Valsalvově manévru nebo ortostatické zkoušce). U těžké DAN se pozoruje tachykardie, která však není obligatorní. Pokud je přítomna, je známkou těžkého postižení vagu, kdy myokard není schopen pružné adaptace na oběhové změny, a navíc, v rámci relativní převahy sympatiku, se snižuje fibrilační práh. Tím jsou objasňovány i případy náhlé srdeční smrti (tj. z autonomní dysbalance), kdy jiné příčiny postižení myokardu nejsou prokázány. U tzv. nebolestivých (němých) infarktů myokardu se rovněž uvažuje o významné roli postižení ANS; jejich bezbolestnost je způsobena postižením autonomních aferentních vláken.
V souvislosti s postižením kardiovaskulárního systému u diabetiků bylo pozorováno snížení hodnot ukazatelů funkčního stavu tohoto systému a významné, kliniky často zcela opomíjené nebo přehlížené, snížení tělesné výkonnosti.
Změny odpovědí TK, kde při ortostatické zkoušce dochází k poklesu systolického TK a při izometrické kontrakci ruky nedochází k adekvátnímu zvýšení diastolického TK, se považují za indikátor postižení sympatiku. OH je pak již projevem těžkého postižení sympatiku u DM. Změny prokrvení dolních končetin u diabetiků s AN jsou spolupodmíněny otevřením arteriovenózních zkratů (shuntů). U těchto nemocných se často zjišťují otoky a mediokalcinóza tepen dolních končetin.
Trofické defekty (např. ulcerace) a přidružené poruchy, nejčastěji na akrech dolních končetin, označované jako diabetická noha, jsou podmíněny jak cévními změnami v rámci makroangiopatie a mikroangiopatie, tak i v důsledku postižení ANS.
Další manifestací DAN na dolních končetinách jsou poruchy pocení (sudomotorické – hypohidróza), jež jsou podmíněny postižením cholinergních vláken sympatiku, a dále symptomy diabetické neuroartropatie.
Kvalitu života diabetiků s DAN snižují příznaky postižení ANS v GIT. Časté jsou poruchy peristaltiky, jež se projevují poruchami motility jícnu, zpomalením evakuace žaludku a změnami pasáže střevy. Atonie žaludku s výrazným zpomalením evakuace se označuje jako „gastroparesis diabeticorum“. Subjektivně si nemocní u této komplikace stěžují na pocity plnosti a nechutenství, občas i s nauzeou a zvracením.
Typickými střevními obtížemi u DAN bývají zácpa (při postižení parasympatiku) nebo charakteristické noční diabetické průjmy objevující se většinou při těžším postižení ANS.
Poruchy močového systému jsou při postižení ANS rovněž časté. Bývají popisovány změny kapacity a poruchy kontraktility močového měchýře. Závažnou známkou postižení bývá neuvědomování si pocitu jeho plnosti v důsledku poruchy viscerální aferentace. Poruchy vyprazdňování močového měchýře vyplývají z poruchy cholinergní inervace detruzoru močového měchýře vlákny sakrálního parasympatiku, zatímco inkontinence bývá často při postižení jeho noradrenergní inervace v oblasti trigona a sfinkteru. Obrazy poruch neurogenního měchýře jsou polymorfní. Výsledky urodynamických vyšetření zachytily nejčastěji hyperreflexii detruzoru, méně často poruchy kontraktility detruzoru a relativně nejméně často areflexii. Významný poznatek vyplývající ze studia ANS u diabetiků je průkaz funkčních poruch již v období subklinickém. To znamená, že urologická vyšetření jsou schopna detekovat již v iniciálních fázích tato postižení a adekvátní terapií pak snížit riziko následných komplikací (např. ascendentních infekcí močových cest).
U mužů se obvykle při delším trvání DM rozvíjí poruchy potence, jež významně frustrují postižené jedince. Prevalence erektilní dysfunkce se u diabetiků pohybuje v rozmezí 20– 60 %.
Další popisovanou poruchou pohlavních funkcí je u mužů s DAN retrográdní ejakulace. U žen bývá projevem postižení ANS snížení poševní sekrece.
Ze sudomotorických poruch lze registrovat při hypohidróze na končetinách hyperhidrózu na trupu a hlavě. Specifický projev poruchy ANS u pacientů s DM představuje pocení na obličeji a horní polovině těla při jídle (tzv. gustatory sweating). Byl pozorován těsný vztah mezi výskytem tohoto fenoménu a tíží neuropatie. V pokročilejších stadiích onemocnění, kdy dojde k postižení cholinergních vláken sympatiku, může být nápadným příznakem anhidróza. Tento nález svědčí pro postganglionární postižení. S anhidrózou bývá spojena intolerance tepla [63,65,66].
U pacientů s DAN byly opakovaně popsány poruchy hormonálních regulací. Typická je hypoglykemie spojená s autonomní dysfunkcí a s neschopností ji registrovat.
Málo registrovaným příznakem postižení ANS u diabetiků jsou poruchy zornicových reakcí.
Projevy diabetické AN (které jsou v jednotlivých systémech organizmu ve většině případů shodné s příznaky AN i jiné etiologie) jsou uvedeny v tab. 1, kdy quod vitam jsou nejzávažnější kardiovaskulární autonomní dysregulace. Na některé další autonomní dysfunkce je zapotřebí zaměřovat cílenou pozornost a vycházet přitom z podrobných anamnestických údajů.
U pacientů s touto diagnózou se diagnostikuje distální symetrická polyneuropatie, kdy u vysokého procenta z nich i AN. U vysokého procenta nemocných tíže AN nekoreluje s tíží distální polyneuropatie. Její projevy bývají méně zřetelné, např. ve srovnání s obrazem AN u diabetiků. Popisuje se těžší postižení vagu ve srovnání s postižením sympatiku. Nejednoznačné změny stavu ANS bývají u těchto nemocných popisovány po transplantacích, kdy u části pacientů dochází ke zlepšení, u zbývajících zůstává stav stacionární [67– 69].
Autonomní neuropatie u jaterních onemocnění
U jaterních onemocnění různé etiologie, vč. cirhózy u alkoholiků, se vedle projevů distální symetrické polyneuropatie prokazují známky poškození ANS. Častým nálezem bývá snížení změn SF ve funkčních zkouškách a snížení variability SF. Abnormální nálezy bývají zachyceny i při vyšetření SSR. U nemocných s rozvinutou AN byla popsána zvýšená četnost encefalopatií. Po transplantaci jater došlo u části pacientů k regresi AN [70,71]. U alkoholiků byly s vyšší četností prokázány známky postižení sympatiku oproti postižení jater jiné etiologie.
U familiární amyloidózy (familiární amyloidóza typu I; FAP I) se prokazuje postižení vláken somatického i autonomního nervového systému, jejichž příčinou jsou amyloidová depozita v obou těchto součástech nervového systému. U ANS byla zjištěna v nervových vláknech i gangliích. Autonomní symptomatika je pestrá – snížení variability SF, OH, poruchy pasáže v trávicím systému, poruchy funkce močového měchýře, poruchy pocení a další. Rovněž i u dalších typů, dříve označovaných jako primární nebo sekundární amyloidóza, které se v současnosti dělí podle biochemických charakteristik, lze zjistit autonomní poruchy [72,73].
Akutní porfyrie představují skupinu metabolických onemocnění s autozomálně dominantní dědičností. Autonomní symptomatika zde bývá dramatická – bolesti břicha, nauzea a zvracení, průjmy nebo zácpa, arteriální hypertenze, tachykardie a poruchy funkce močového měchýře [74].
Akutní zánětlivá demyelinizační polyradikuloneuritida (Guillain-Barrého syndrom) postihuje, zejména u těžších průběhů, vedle somatického nervového systému i ANS. Manifestací je klidová tachykardie, arytmie nebo snížení variability SF, z dalších oběhových příznaků jsou popisovány velké kolísání hodnot TK nebo OH. V časné fázi onemocnění bývají přítomny projevy převažující aktivity sympatiku, zatímco později se objevují poruchy (snížení aktivity) parasympatiku, resp. vagu. Autonomní dysfunkce se objevují hlavně u nemocných s těžšími parézami, kde se vedle kardiovaskulárních poruch prokazují poruchy funkce močového měchýře a pocení, a mohou být dokonce příčinou jejich smrti [75].
Postižení autonomního nervového systému u systémových autoimunitních onemocnění
Z autoimunitních onemocnění, která jsou provázena známkami postižení sympatiku a parasympatiku, sem spadají systémový lupus erythematodes, sklerodermie, Sjögrenův syndrom a další systémová onemocnění pojiva.
Autoimunitní autonomní gangliopatie
Toto vzácné onemocnění se sporadickým výskytem je charakterizováno autoprotilátkami proti nikotinovým acetylcholinovým receptorům. Při rychlém rozvoji obtíží bývalo označováno také jako akutní pandysautonomie nebo jako idiopatická AN. Dochází k postižení sympatiku, parasympatiku i enterického systému. Klinicky se projevuje OH, opakujícími se synkopami, poruchami zornicových reakcí, obrazem suchého oka a suchostí v ústech, poruchami funkce žaludku (gastroparézou) a střev a neurogenním měchýřem s retencí moči [76– 78].
Akutní dysautonomie u infekčních onemocnění
Častější výskyt autonomních dysfunkcí v rámci infekčních nebo parainfekčních imunitních poruch byl popsán u infekční mononukleózy (Epstein-Barr virus), u infekcí herpes virus simplex a virem coxsackie B, u difterie, lepry a dalších. V posledních letech se zjišťuje s vysokou četností u pacientů HIV pozitivních. Clostridium botulinum způsobuje postižení nejen somatického, ale i ANS, kde v popředí symptomatiky je cholinergní dysfunkce. Ve světě je jednou z nejčastějších infekcí postihujících ANS trypanosomiasis cruzi, známá spíše jako Chagasova nemoc, u níž autonomní poruchy postihují hlavně oblast kardiovaskulární a GIT [79,80].
Paraneoplastické autonomní neuropatie
Nádorová onemocnění jsou provázena senzitivní neuropatií, senzitivně-motorickou neuropatií, ale také i AN. S vysokou frekvencí se tato AN zjišťuje u pacientů s malobuněčným plicním karcinomem. Nekonstantní výskyt autonomních poruch bývá i u dalších malignit postihujících pankreas, trávicí systém, ledviny, testes a ovaria, dále u karcinomu prsu, prostaty a močového měchýře.
Klinické projevy jsou polymorfní a postihují více systémů organizmu. Mezi manifestace patří poruchy střevní pasáže, OH, poruchy pocení a funkce močového měchýře.
Lambert-Eatonův syndrom s poruchami neuromuskulárního přenosu jak u malignit, tak u osob bez nádorového onemocnění, bývá rovněž provázen dysautonomními příznaky [81,82].
Čisté autonomní selhání
Názvu „čisté autonomní selhání“ (pure autonomic failure; PAF) se nyní dává přednost před starším označením tohoto stavu – idiopatická OH (kdy dalším označením této jednotky bylo Bradbury-Egglestoneův syndrom) – a diferenciálně diagnosticky se musí tato jednotka odlišovat od OH, která je pouze součástí jiných onemocnění postihujících ANS (z nich uvádíme jako nejčastější příčiny OH např. těžké AN u metabolických onemocnění, multisystémovou atrofii [MSA] nebo OH u Parkinsonovy nemoci). Histopatologicky byla u PAF zachycena akumulace α-synukleinu v periferních autonomních neuronech, která vede k postižení gangliových a postgangliových neuronů ANS. Při speciální laboratorní diagnostice se u pacientů s PAF zjišťují vleže velmi nízké hladiny noradrenalinu, kdy ani po postavení nedochází k jejich zvýšení.
Pacienti s PAF mají v popředí klinického obrazu OH spolu se známkami širšího postižení ANS, jako např. s poruchami funkce močového měchýře a se sexuálními poruchami. Nemají však žádné prokazatelné poruchy čití nebo mozečkových funkcí, rovněž nejsou přítomny pyramidové nebo extrapyramidové příznaky. Jedním z kritérií pro stanovení diagnózy je pokles systolického TK nejméně o 20 mm Hg (u hypertoniků nebo u osob s hypertenzními hodnotami vleže nejméně o 30 mm Hg) a diastolického nejméně o 10 mm Hg po 3 min stoje. Po letech trvání tohoto onemocnění byly u části pacientů popsány přechody i v jiná onemocnění ANS, a to dokonce s centrálním typem postižení, jako je např. MSA [83– 85].
Toxicky a lékově a vyvolané autonomní dysfunkce
Autonomní dysfunkce nebo neuropatie z exogenních příčin mohou být způsobeny toxickými látkami nebo léčivy s toxickým působením na ANS. Z léků jsou nejčastější příčinou cytostatika, z nich konkrétně cisplatina, paclitaxel a vincristin. Z toxických látek se autonomní poruchy prokazují po expozici organickým rozpouštědlům, akrylamidu a těžkým kovům. Alkohol má akutní i chronický nepříznivý účinek na ANS, kdy opakované podávání vede k rozvoji periferní i AN. Botulotoxin (jak již bylo uvedeno u autonomních poruch v souvislosti s infekcemi) vede u postižení ANS k dominantní poruše parasympatiku [86].
U lékově vyvolaných autonomních dysfunkcí nelze opomenout stavy, u nichž je změna aktivity sympatiku nebo parasympatiku (vagu) podmíněna přímým nebo nepřímým účinkem léčiva na receptory obou těchto subsystémů ANS. Poruchy parasympatiku v rámci anticholinergních účinků (poruchy akomodace, xerostomie, tachykardie, snížení sekrece žláz, vč. hypo - až anhidrózy, porucha termoregulace, zpomalení pasáže trávicím traktem a zácpa, poruchy funkce močového měchýře a další) jsou typické pro tricyklická antidepresiva, antipsychotika (dříve označovaná jako neuroleptika), antihistaminika H1 a další. Známky snížení aktivity sympatiku, z nichž nejvýznamnější je OH, způsobuje podávání α-sympatolytik nebo nepřímých sympatolytik, dále také levodopy a dopaminových agonistů. Stavem akutně ohrožujícím život pacientů je prudké vysazení opioidů, beta-blokátorů a benzodiazepinů, kdy může dojít k hyperaktivaci sympatiku spojené se závažnými oběhovými poruchami [86].
Centrální autonomní poruchy a dysfunkce
Charakteristiky nemocí a postižení centrálního autonomního nervového systému
Autonomní poruchy u Parkinsonovy nemoci
Dlouhotrvající autonomní dysfunkce se běžně vyskytují u nemocných s Parkinsonovou nemocí. Autonomní příznaky a poruchy se mohou objevovat i před rozvojem motorických příznaků nebo již v časných stadiích onemocnění. Z projevů postižení ANS lze často registrovat snížení variability SF, zvýšený mazotok (seboreu), poruchy funkce močového měchýře, zácpu, sníženou toleranci tepla (v rámci poruch termoregulace) a poruchy sexuálních funkcí. Charakteristické slinění není zřejmě důsledkem hypersalivace, nýbrž se na něm podílejí i poruchy polykání. Symptomem postižení ANS, konkrétně sympatiku, je OH. Tu je zapotřebí, jako jeden z projevů nemoci, odlišit od účinku léků obsahujících levodopu a od účinků agonistů dopaminových receptorů, které svými farmakologickými účinky přispívají k rozvoji arteriální hypotenze. Při výrazných projevech poruch autonomních funkcí se stav označuje jako Parkinsonova nemoc s autonomním selháním. [85,87– 91].
Multisystémová atrofie
Skupinu onemocnění spadající pod tento název lze charakterizovat jako progresivní sporadická onemocnění CNS a ANS. Označení MSA nahradilo starší označení diagnóz, jako olivopontocerebelární atrofie, Shy-Dragerův syndrom a striatonigrální degenerace. Z histopatologických změn bylo popsáno snížení počtu neuronů – podle forem MSA – v bazálních gangliích, v nucleus olivae inferior, v mozečku a v míše v intermediolaterálním sloupci (pro sympatikus) a v nucleus Onufi. Vedle toho byly zachyceny gliální cytoplazmatické inkluze. U MSA se v různých kombinacích objevují příznaky autonomních dysfunkcí – OH, poruchy funkce močového měchýře a sexuální poruchy a další. Podle současně přítomných příznaků postižení CNS se MSA dělí na tři formy: 1. parkinsonizmus s OH; 2. s cerebelárními nebo pyramidovými příznaky; 3. smíšená forma – má v popředí autonomní projevy, které předcházejí nebo se objevují krátce po rozvoji příznaků postižení CNS. U MSA s parkinsonskou symptomatikou je malá odezva na léčbu levodopou [85,92– 94].
Demence s Lewyho tělísky
Je obtížně diagnostikovatelná jednotka, která má vedle kognitivních poruch, připomínajících Alzheimerovu nemoc, i parkinsonskou symptomatiku. Při biopsii bývají Lewyho tělíska zjišťována v neokortexu a v limbické oblasti, kromě toho bývají přítomna i v nucleus niger – jako u Parkinsonovy nemoci. Tato nemoc bývá zařazována mezi tzv. synukleinopatie, vzhledem k průkazu stejnojmenného patologického proteinu obsaženého v Lewyho tělískách a v Lewyho neuritech, který bývá vedle demence s Lewyho tělísky zjišťován i u Parkinsonovy nemoci a u MSA.
Nápadné bývá kolísání úrovně bdělosti, pozornosti, kognitivních poruch v průběhu dne a časté jsou u těchto pacientů zrakové halucinace. Již před rozvojem dalších klinických projevů onemocnění se mohou objevovat abnormní motorické a behaviorální projevy v REM fázi spánku (označované jako REM sleep behavior disorder), které se zařazují mezi parasomnie. Z autonomních poruch se objevují hlavně OH, která se může podílet na opakovaných pádech, nebo také postprandiální hypotenze. Postižení srdečních vláken sympatiku zde bylo prokázáno scintigrafickými metodami. Pro močový systém se popisují noční polyurie a/ nebo poruchy funkce močového měchýře. Z dalších obtíží spojených s dysfunkcí ANS se opakovaně registrují obstipace a u mužů erektilní dysfunkce [92,95].
Fatální familiární insomnie
Choroba s autozomálně dominantní dědičností zařazovaná vzhledem k místu genové mutace pro prionový protein PrP mezi prionová onemocnění. Hlavním příznakem je úporná, nezvládnutelná nespavost spojená s příznaky zvýšené činnosti sympatiku, jako jsou tachykardie, arteriální hypertenze, nadměrné pocení a horečka. Součástí klinického obrazu jsou motorické a psychické poruchy. Prognóza je zcela nepříznivá quod vitam. Charakteristické patologické změny se zjišťují v oblasti anteroventrálních a dorzomediálních jader talamu [96].
Rettův syndrom
Onemocnění vázané na X chromozom postihuje téměř výhradně dívky. Vzniká většinou mutací genu MECP2 pro metyl-CpG vazebný protein 2, který je významný pro maturaci neuronů, synaptogenezi a plasticitu CNS. Familiární výskyt je vzácný. Projevy syndromu jsou zpomalení růstu hlavy od prvního roku života, zhoršování nebo ztráta komunikačních schopností, stereotypní pohyby rukou, záchvaty, amyotrofické změny na dolních končetinách a další projevy, k nimž se řadí poruchy ANS – snížení variability SF, arytmie, poruchy dýchání, změny teploty a barvy kůže na dolních končetinách a poruchy funkce trávicího systému [97– 99].
Autonomní poruchy u míšních poranění
U míšních poranění nad úrovní segmentů Th5– Th6 se významně častěji než u nižších postižení objevují závažné poruchy autonomních funkcí. Patofyziologicky jsou podmíněny přerušením supraspinální kontroly na míšní struktury („centra“) sympatiku. Po vertikalizaci se rozvíjí OH. Přitom vleže se častěji zachycují hypertenzní hodnoty, které závisejí na výšce míšní léze. Po různých stimulačních podnětech pod úrovní míšního postižení, zejména nocicepčních, se často objevují prudký a výrazný vzestup TK, bradykardie, silné bolesti hlavy, pocení a nápadná změna barvy (zarudnutí) obličeje. Tyto stavy, označované také jako autonomní dysreflexie, bývají vyvolány nejen vnějšími (jako např. taktilními na kůži), ale i vnitřními podněty jako naplněním močového měchýře nebo konečníku. Obdobná autonomní symptomatika bývá zachycena při tzv. mass reflexu, kde se vedle toho objevují fenomén trojflexe, pomočení a/ nebo pokálení, u mužů pak i erekce. Po prudkém zvýšení TK byla u těchto pacientů opakovaně popsána intrakraniální krvácení.
Autonomní dysreflexie se objevuje nejen u úplných, ale i u částečných přerušení míchy. Mezi nejzávažnější postižení těchto pacientů patří poruchy mikce při rozvoji neurogenního měchýře. Z dalších dysautonomních projevů lze registrovat poruchy pocení a termoregulace a změny prokrvení kůže. Postižení trofických autonomních vláken se podílí na rozvoji dekubitů. Ze sexuálních poruch bývá u mužů častá erektilní dysfunkce, kdy po některých stimulacích se naopak objevuje priapizmus. Ejakulace u nich bývá často retrográdní. Pacienti s míšním postižením vyžadují zvýšenou pozornost i u operací, protože porušení regulace sympatiku může vést při intubaci k reflexním poruchám srdečního rytmu až k srdeční zástavě, vyvolaným aktivací vagu [100– 104].
Autonomní poruchy u dalších onemocnění nervového systému
V mnoha případech unikají pozornosti, protože klinik se zaměřuje na dominantní symptomy postižení nemocného. Proto nejsou vedle motorických, senzitivních a psychických příznaků popisovány často důležité symptomy autonomních dysfunkcí. U části nemocných se po CMP v oblasti mozkových hemisfér rozvíjejí poruchy srdečního rytmu, snížení variability SF, změny hodnot TK a ortostatické poruchy, časté jsou poruchy dechu, pocení, termoregulace, kontinence, cévní dysregulace na postižených končetinách a další autonomní poruchy, které nebývají mnohdy registrovány [8,105,106]. Byly popsány i odlišné obrazy poruch funkce ANS v závislosti na lokalizaci CMP [107– 109].
Srdeční dysrytmie zvyšující riziko kardiální mortality bývají zachyceny i u pacientů po těžkých kraniocerebrálních traumatech,vč. intrakraniálních hemoragií traumatického původu [110]. Změny variability srdeční jako projevu autonomní dysregulace byly popsány u osob s dětskou mozkovou obrnou [111].
U epileptických syndromů se objevují různé autonomní dysregulace a poruchy. Závažné jsou zejména oběhové, charakteru sinusové nebo supraventrikulární tachykardie, síňové nebo komorové fibrilace, případně jiné typy srdečních dysrytmií. Ty mohou předcházet náhlému úmrtí pacientů s epilepsií (sudden unexpected death in epileptic patients; SUDEP). Příčina zde v mnoha případech nebývá jednoznačně prokazatelná a předpokládají se kardiální autonomní dysregulace, které vedou k letálním arytmiím [112]. Z dalších autonomních projevů spojených s epileptickými záchvaty se častěji registrují dysfunkce sfinkterové (inkontinence) a sexuální projevy.
Jedním z projevů léze v oblasti diencefalické je epizodická hyperhidróza s hypotermií a paroxysmální autonomní hyperaktivitou.
Pacienti s RS mozkomíšní trpí často autonomními poruchami, nejčastěji poruchami funkce močového měchýře (detruzorově-sfinkterová dyssynergie nebo neurogenní měchýř), či kardioregulačními, kdy u těžších forem se objevují i ortostatické dysfunkce [113– 115]. Symptomatika syringomylie a syringobulbie zahrnuje vedle charakteristických senzitivních (disociace čití) a motorických i příznaky autononomní – kolísání hodnot TK, OH, poruchy řízení SF a centrální poruchy dýchání [116]. Dysrytmie byly opakovaně zachyceny u osob se syndromem spánkové apnoe [117,118].
U patologických procesů různé etiologie postihujících mozkový kmen se objevuje autonomní symptomatika při jejich lokalizaci v místě jader parasympatiku (n. III., n. VII., n. IX. a n. X.). Stejně tak i v místě funkčně významných autonomních struktur, jako je např. nucleus tractus solitarii. Obrazy poruch funkce sympatiku se objevují u patologických procesů v rostrálních ventrolaterálních oblastech prodloužené míchy, poruchy baroreflexů u oboustranného postižení nucleus tractus solitarii [119,120]. Centrální hypoventilace patří mezi projevy postižení ventrální a dorzální skupiny jader prodloužené míchy regulujících respiraci. Kardiovaskulární, respirační, sudomotorické a gastrointestinální autonomní symptomy bývají součástí obrazu postižení v oblasti pontomedulární [121]. Rovněž u postižení mozečku, v rámci spinocerebelární ataxie typu 3,byly popsány kardiovaskulární autonomní dysfunkce a snížení variability SF. Polymorfní a variabilní autonomní dysfunkce u postižení struktur různé etiologie v oblasti hemisfér a mozkového kmene se mají pečlivě registrovat, zejména pro potřebu sledování ukazatelů činnosti kardiovaskulárního systému (nejlépe v rámci monitoringu) těchto pacientů, aby se preventivně nebo včasnými intervencemi zabránilo náhlé srdeční smrti, která bývá častým následkem závažných autonomních dysregulací [105].
Další stavy a diagnózy s autonomními dysfunkcemi
Synkopy
Synkopální stavy obecně stojí na pomezí diagnostiky neurologie a vnitřního lékařství, zde hlavně kardiologie. Jsou charakterizovány krátkodobou ztrátou vědomí v důsledku přechodné hypoperfuze mozku, která je obvykle spojena se ztrátou posturálního tonu. Diferenciálně diagnosticky je nutné rozpoznat jednotlivé typy a odhalit provokující faktory, resp. příčiny těchto stavů. Neurolog by měl být seznámen se symptomatikou a možnostmi průkazu jednotlivých typů synkop. V současné době se užívá rozdělení do čtyř kategorií: nervově zprostředkované synkopy, OH, kardiální synkopy a cerebrovaskulární synkopy. Mezi nervově zprostředkované se zařazují vazovagální synkopy (spojené s arteriální hypotenzí a bradykardií, případně až s přechodnou asystolií), situační synkopy (mikční, defekační, tusigenní nebo při polykání) a dále sem patří i syndrom karotického sinu. Do skupiny synkop při OH se zařazují synkopy při autonomních poruchách a onemocněních, vedle toho i lékově vyvolané hypotenze nebo synkopy při hypovolémii. Mezi kardiálně podmíněné synkopy patří ty, které jsou vyvolány organickým onemocněním srdce nebo arytmiemi. Cerebrovaskulární synkopy jsou způsobeny hypoperfuzí mozku, vč. tzv. steal syndromu [122– 125].
Syndrom posturální ortostatickétachykardie (POTS)
U pacientů se objevuje ortostatická intolerance a vedoucím příznakem je zvýšení SF o 30 a více tepů za min nebo hodnota SF vyšší než 120/ min během 5– 10min stoje nebo v testu na nakloněné rovině. V typických případech nebývá OH. U varianty tohoto syndromu se však vedle tachykardie rozvíjí i arteriální hypotenze, závrativost, nauzea a stavy únavy. Etiologie není jednotná, proto se syndrom posturální ortostatické tachykardie dále dělí na následující formy: neuropatickou (dysautonomní), hyperadrenergní, hypovolemickou a při nízké tělesné zdatnosti. Příčina těchto stavů není zcela objasněna. U části pacientů se považuje za projev autonomních dysregulací, u části byl popsán vznik po prodělání infekčního onemocnění [122,126– 128].
Tetanie
Klinická symptomatika u tetanie postihuje systémy nervový, kardiovaskulární, respirační a další. Většina projevů je spojena se známkami zvýšené nervosvalové dráždivosti, která je příčinou obtíží a kterou lze v klinické praxi snadno prokázat pozitivitou zkoušek a fenoménů – Chvostkova, Trousseauova, Lustova a Trömnerova (ten je projevem nejen spasticity, ale také zvýšené neuromuskulární excitability).
Pacienti s tetanií vedle senzitivních příznaků (parestezií) a svalových křečí popisují ve spektru svých obtíží autonomní symptomy – poruchy srdečního rytmu, palpitace, ztížené dýchání nebo pocit nedostatku vzduchu, zvýšené pocení, vertiginozitu, někdy rozvoj prekolapsových nebo až kolapsových stavů. Terapii vyžadují záchvaty úzkosti spojené s hyperventilací (zde je nutno diferenciálně diagnosticky odlišit od panických atak). Někteří popisují imperativní nucení na močení nebo na stolici. Tito nemocní mívají snížený práh bolesti a rovněž bolest hůře tolerují. Ve vysokém procentu se u nich v anamnéze zjišťuje migréna, tenzní bolesti hlavy nebo bolesti pohybového systému. Diagnostika je elektrofyziologická (ischemický a hyperventilační test), kde pro diagnózu svědčí výskyt dubletů a tripletů, a dále biochemická k vyloučení hypomagnezemie nebo hypokalcemie. Při hodnocení kardiální autonomní regulace u osob s elektrofyziologicky prokázanou tetanií byla zjištěna mírně zvýšená dráždivost sympatiku [129].
Terapie je snadná tam, kde je zjištěn deficit některého z uvedených minerálů. Dlouhodobá substituce vede ve většině případů ke zlepšení stavu.
Kritické stavy a autonomní dysfunkce
Opomíjenou oblastí je podrobnější hodnocení stavu ANS u kritických stavů a u pacientů s multiorgánovým selháním. Přitom zachovaná autonomní regulace rozhoduje velmi významně o udržení homeostázy organizmu. U těchto stavů se rozvíjejí polyneuromyopatie kritického stavu. Autonomní dysfunkce se manifestuje snížením variability SF a baroreflexní regulace. Míra autonomní dysregulace přitom predikuje i mortalitu těchto nemocných. Zejména spektrální hodnoty z pásma velmi nízké frekvence umožňují posoudit vlivy parasympatiku/ vagu. Jejich výrazné snížení nasvědčuje špatné prognóze [130,131].
Vybrané lokalizované autonomní poruchy
Hornerův syndrom
Tento syndrom je charakterizován miózou, parciální ptózou víčka, enoftalmem a u některých pacientů anhidrózou nebo zarudnutím na postižené straně obličeje. Synonymicky bývá označován také jako okulosympatická paréza. Klinický obraz je způsoben postižením centrálních nebo periferních struktur a vláken sympatiku, resp. jeho ganglií pro oblast hlavy, oka a krční úsek. Místy poškození mohou být kmenové struktury (výjimečně diencefalické), Budgeovo centrum v míše nebo vlákna sympatiku pre - nebo postganglionární (z ganglion cervicale superius) [132].
Adieho syndrom
Adieho syndrom (označovaný také jako Holmesův-Adieho syndrom) se projevuje anizokorií s mydriázou na postižené straně, kde chybí nebo je velmi zpomalená fotoreakce a reakce na konvergenci (pupilotonie). Popsaný nález bývá spojen s vymizením napínacích reflexů a u části pacientů i s další autonomní symptomatikou, vč. dysregulací kardiovaskulárních. U některých pacientů se projevy širší autonomní dysfunkce rozvíjejí až s latencí po zornicových změnách. Výjimečně se porucha zornicových reakcí objevuje oboustranně. Jako postižené struktury bývají popisovány ganglion ciliare a nervi ciliares breves [133].
Komplexní regionální bolestivý syndrom
Komplexní regionální bolestivý syndrom byl dříve znám pod mnoha synonymy – Sudeckův syndrom, algoneurodystrofický syndrom, reflexní sympatická dystrofie, sympatikem udržovaná bolest a ještě i pod dalšími názvy. Dnes je terminologicky rozlišen na dvě jednotky, a to na KRBS typu I, který odpovídá charakteristikám výše uvedených synonymických názvů a zahrnuje známky současného postižení motoriky, čití, spolu s poruchami autonomními (a trofickými), bez klinicky zřetelného postižení spinálních nervů. Druhá jednotka je KRBS typu II, který se dříve označoval jako kauzalgie. Klinický obraz je obdobný, bývá zde však prokazatelné poškození periferních (somatických) nervů, které nemá být přítomno u KRBS typu I. Nejnovější poznatky ovšem nasvědčují tomu, že i u KRBS typu I lze laboratorně nervové poškození prokázat, avšak pouze tenkých vláken pro nocicepci a termocepci [134,135].
Syndrom krokodýlích slz
Tato relativně vzácná lokalizovaná autonomní dysfunkce (označovaná též jako Bogoradův syndrom nebo jako gustolakrimální reflex či též jako paroxysmální lakrimace) se objevuje u periferního postižení n. facialis, jako např. u Bellovy obrny nebo po traumatickém postižení vláken tohoto nervu. Manifestuje se slzením při žvýkání a příjmu potravy, což je způsobeno nesprávnou reinervací vláken pro slinnou žlázu v rámci regenerace. Regenerující vlákna inervují místo toho slznou žlázu, a proto dochází při žvýkání k její sekreci [136,137].
Harlekýnský syndrom
Projevem tohoto syndromu je pocení a zarudnutí na jedné polovině obličeje, krku a horní části stejné poloviny hrudníku, zejména po fyzické zátěži, po silných emočních podnětech nebo v teplém prostředí. Druhá polovina obličeje přitom zůstává bledá a suchá, protože na této straně jsou postižena sudomotorická a vazomotorická vlákna sympatiku. Syndrom může být způsoben zcela odlišnými příčinami – neurologickými, traumatologickými, autoimunitními, endokrinními, onkologickými i iatrogenními [138– 140].
Diagnostika poruch autonomního nervového systému v podmínkách klinické praxe
Po přehledu generalizovaných a lokalizovaných onemocnění a poruch ANS jsou před závěrem práce uvedeny použitelné postupy vyšetření tohoto systému pro dvě úrovně vybavenosti neurologických pracovišť.
Základní a rozšířené vyšetření autonomního nervového systému
Vyšetření ANS lze rozdělit do tří okruhů: 1. hodnocení kardiovagálních regulací, při nichž se posuzují změny SF nebo VSF; 2. hodnocení adrenergní funkce sympatiku, v nichž se posuzují změny TK ve zvolených zkouškách – slouží zejména k průkazu OH (tj. postižení sympatiku); 3. hodnocení sudomotoriky, které dává informaci o funkci cholinergní inervace potních žláz. Vlastní doporučený postup diagnostiky AN vydala Česká diabetologická společnost ČLS JEP. Tento může posloužit jako základní vodítko i našim neurologům [141].
Základní vyšetření lze provádět zcela bez speciálního vybavení, postačí k němu hodinky a tonometr. Úvodem by měla být věnována velká pozornost anamnéze, kdy k systematickému sběru údajů o možných poruchách ANS může posloužit tab. 1 z tohoto článku a/ nebo použití dotazníků na autonomní funkce [9– 14].
I v tomto základním vyšetření lze posoudit kardiovagální regulace a adrenergní funkci sympatiku. Kardiovagální funkce lze zcela orientačně hodnotit podle míry respirační sinusové arytmie při hlubokém dýchání, tj. zda je možné zachytit kardioakceleraci při inspiriu a kardiodeceleraci při exspiriu (i bez stanovení přesných hodnot SF). Snadněji kvantifikovatelná je odpověď SF na postavení (ortostatická zkouška), kde se porovnává SF vsedě (nebo vleže) a následně má dojít – po pomalém postavení – v prvních 10 s ke zvýšení SF, po 20. s se má začít rozvíjet zpomalování SF. Pokud je k dispozici možnost EKG záznamu, lze změny SF kvantifikovat přesně [22,23]. Adrenergní funkce sympatiku se dají posoudit porovnáním hodnot systolického a diastolického TK vleže a poté po 3 min klidného stoje. Kritéria pro diagnostiku OH byla stanovena [19,20] a jsou uvedena v tomto článku.
Rozšířené vyšetření by mělo zahrnovat vyšetření všech tří okruhů, tj. vč. vyšetření sudomotoriky. Vyšetření kardiovagálních funkcí v kardiovaskulárních autonomních reflexních zkouškách slouží nejspolehlivěji zkouška hlubokého dýchání a ortostatická zkouška. (Valsalvův manévr může být u některých pacientů kontraindikován, proto nemusí být nezbytnou součástí těchto vyšetření.) Ke kvantifikaci ukazatelů změn SF lze použít ukazatele z testů podle Ewinga et al (tab. 3). Vedle tohoto způsobu hodnocení jsou v kardiovagálních testech přínosné pro hodnocení změn SF v hlubokém dýchání a ortostatické zkoušce i indexy podle dalších autorů, vč. jimi stanovených referenčních hodnot pro věková rozmezí [142]. Další možnost, jež poskytuje podrobnější hodnocení kardiální autonomní regulace, je spektrální analýza variability SF [22,24,25] umožňující ve zkoušce leh-stoj-leh (tj. zkoušce ortoklinostatické) posouzení dynamiky odpovědí vagu na ortostatickou zátěž. Alternativu vyšetření variability SF představují v klinické praxi zatím málo dostupné a na interpretaci náročnější metody nelineární dynamiky [28,29]. Adrenergní funkce sympatiku se vyšetřují stejným způsobem, jak je popsáno výše, v základním vyšetřovacím postupu pro hodnocení změn TK. Pro hodnocení sudomotoriky jsou vyšetření míry pocení, jako např. QSART, u nás dosud málo dostupná. Mnohem častěji se využívá vyšetření SSR [42].
Širší možnosti vyšetření ANS, tj. použití i dalších vyšetřovacích postupů, podávají práce zaměřené na tuto problematiku [15– 21,143,144]. Přitom spolehlivost diagnostiky poruch ANS se zvyšuje podle zkušeností mnoha zahraničních autorů a laboratoří při použití nejméně dvou metod hodnocení autonomních odpovědí ve vhodně zvolených zkouškách.
Závěr
Klinicky manifestované a/ nebo laboratorně diagnostikované dysfunkce a onemocnění ANS představují nejen zhoršení zdravotního stavu a kvality života, ale současně i zvýšení rizika pro rozvoj dalších zdravotních komplikací a zvýšení rizika komplikací při provádění některých lékařských výkonů u těchto pacientů. Zejména kardiovaskulární autonomní dysfunkce jsou nepříznivým prognostickým faktorem quod vitam a měly by být včas registrovány. Je potřebné zdůraznit, že velká část autonomních poruch se nevyskytuje samostatně, ale doprovází jiná onemocnění (různé etiologie) nebo úrazy centrálního či periferního nervového systému. Proto při zaměření neurologů na klinickou symptomatologii základního onemocnění nebo stavu mohou unikat více či méně vyjádřené projevy postižení ANS. Z toho důvodu narůstá potřeba dostupnosti citlivých vyšetření schopných zachytit ještě subklinické fáze autonomních poruch. Rozvoj techniky přitom v současné době umožňuje nejen klinickým pracovištím vyššího typu, ale i neurologickým ambulancím provádět alespoň základní vyšetření zaměřená na funkce ANS. V souladu s tím se zvyšuje možnost včasné diagnostiky a včasného záchytu autonomních poruch i v našich zdravotnických zařízeních. Stanovení správné diagnózy typu autonomního postižení by mělo mít svůj dopad jak na pacienta, tak na lékaře. Průkaz AN nebo dysfunkcí totiž vyžaduje ve většině případů významný zásah do denního i léčebného režimu těchto nemocných. Pro lékaře má pak zachycení autonomních poruch význam signální, protože takový pacient vyžaduje zvýšenou pozornost a péči. Cílem tohoto příspěvku bylo podat stručný přehled spektra diagnóz s generalizovaným nebo lokálním postižením ANS spolu s uvedením jejich charakteristik a dále seznámit s dostupnými metodami vyšetřování tohoto subsystému nervové soustavy v podmínkách běžné klinické praxe.
Seznam zkratek
123I-MIBG – 123I-metaiodobenzylguanidin
ANS – autonomní nervový systém
AN – autonomní neuropatie
DAN – diabetická autonomní neuropatie
DM – diabetes mellitus
GIT – gastrointestinální trakt
FAP I – familiární amyloidóza typu I
HSAN – hereditární senzitivní a autonomní neuropatie
KRBS – komplexní regionální bolestivý syndrom
MSA – multisystémová atrofie
OH – ortostatická hypotenze
PAF – čisté autonomní selhání
QSART – kvantitativní sudomotorický test
SAVSF – spektrální analýza variability srdeční frekvence
SF – srdeční frekvence
SSR – sympatická kožní odpověď
TK – krevní tlak
VSF – variabilita srdeční frekvence
Přijato k recenzi: 24. 7. 2018
Přijato do tisku: 5. 11. 2018
prof. MUDr. Jaroslav Opavský, CSc.
Katedra fyzioterapie, Fakulta tělesné kultury, Univerzita Palackého v Olomouci
třída Míru 117
771 11 Olomouc
e-mail: jaroslav.opavsky@upol.cz
prof. MUDr. Jaroslav Opavský, CSc.
Jaroslav Opavský promoval v roce 1975 na lékařské fakultě UP v Olomouci. Po promoci nastoupil na neurologické oddělení Ústavu pro výzkum vyšší nervové činnosti v Olomouci a od roku 1979 vedl poradnu pro bolesti hlavy a bolestivé stavy v neurologii na Neurologické klinice LF UP a FN v Olomouci.
V roce 1979 složil atestaci I. stupně a v roce 1984 II. stupně z neurologie. V odborné činnosti se zaměřoval na bolestivé stavy, poruchy autonomního nervového systému, na neurofarmakologii a farmakoterapii a později na rehabilitaci a neurorehabilitaci. V roce 1987 obhájil kandidátskou dizertační práci zaměřenou na diagnostiku poruch autonomního nervového systému. Několik let pracoval i na Farmakologickém ústavu LF UP v Olomouci. Více než 25 let byl členem výboru Neurofarmakologické komise ČNS. Je zakládajícím členem Společnosti pro studium a léčbu bolesti ČLS JEP, kde je od počátku členem jejího výboru. Je rovněž zakládajícím členem Sekce pro diagnostiku a léčbu bolesti hlavy ČNS, kde byl řadu let členem jejího výboru. Získal atestaci z oboru Fyziatrie, balneologie a léčebná rehabilitace (FBLR) (nyní obor Rehabilitační a fyzikální medicína [RFM]) a byl opakovaně členem výboru této společnosti. Později získal specializovanou způsobilost v oboru paliativní medicína a léčba bolesti (nyní Algeziologie). Z mezinárodních odborných společností je členem International Association for the Study of Pain (IASP) a International Headache Society (IHS). Od roku 1994 je vedoucím katedry fyzioterapie a garantem studijního programu Fyzioterapie na FTK UP a vedoucím lékařem RRR Centra léčby bolestivých stavů v Olomouci. V roce 2000 obhájil habilitační práci na téma diabetické autonomní neuropatie a byl jmenován docentem pro obor neurologie. Titul profesora v tomto oboru získal v roce 2004. Je autorem nebo spoluautorem více než 180 časopiseckých prací a prezentoval více než 450 sdělení. Je autorem dvou monografií a jednoho učebního textu a přispěl kapitolami do několika dalších monografií a učebních textů. V roce 2001 jeho práce zvítězily ve svých sekcích na kongresu IHS v New Yorku a v roce 2003 na sjezdu European Federation
Zdroje
1. Benarroch EE. Central autonomic control. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 9– 12. doi: 10.1016/ B978-0-12-386525-0.00002-0.
2. Cersosimo MG, Benarroch EE. Central control of autonomic function and involvement in neurodegenerative disorders. Handb Clin Neurol 2013; 117 : 45– 57. doi: 10.1016/ B978-0-444-53491-0.00005-5.
3. Mathias CJ. Autonomic disorders and their recognition. N Engl J Med 1997; 336(10): 721– 724. doi: 10.1056/ NEJM199703063361010.
4. Critchley HD, Eccles J, Garfinkel SN. Interaction between cognition, emotion, and the autonomic nervous system. Handb Clin Neurol 2013; 117 : 59– 77. doi: 10.1016/ B978-0-444-53491-0.00006-7.
5. Benarroch EE. Anatomy and function of the peripheral autonomic system. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 15– 30. doi: 10.1093/ med/ 9780199920198.003.0002.
6. Langley JN. The autonomic nervous system. Cambridge: W. Heffer and Sons, Ltd. 1921.
7. Hamill RW, Shapiro RE, Vizzard M. Peripheral autonomic nervous system. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 17– 26. doi: 10.1016/ B978-0-12-386525-0.00004-4.
8. Gall A, Craggs M. Autonomic nervous system dysfunction. In: Dietz V, Ward NS (eds). Oxford textbook of neurorehabilitation. Oxford: Oxford University Press 2015 : 89– 111. doi: 10.1093/ med/ 9780199673711.003.0010.
9. Kaiserová M, Opavský J, Maertin JJ et al. Česká verze autonomic scale for outcomes in Parkinson’s disease (SCOPA-AUT) – dotazníku k hodnocení přítomnosti a závažnosti příznaků autonomních dysfunkcí u pacientů s Parkinsonovou nemocí. Cesk Slov Neurol N 2014; 77/ 110(1): 96– 99.
10. Opavský J. Autonomní nervový systém a diabetická autonomní neuropatie. Klinické aspekty a diagnostika. Praha: Galén 2002 : 130– 134.
11. Sletten DM, Suarez GA, Low PA et al. COMPASS 31: a refined and abbreviated Composite Autonomic Symptom Score. Mayo Clin Proc 2012; 87(12): 1196– 1201. doi: 10.1016/ j.mayocp.2012.10.013.
12. Treister R, O’Neil K, Downs HM et al. Validation of the composite autonomic symptom scale 31 (COMPASS-31) in patiens with and without small fiber polyneuropathy. Eur J Neurol 2015; 22(7): 1124– 1130. doi: 10.1111/ ene.12717.
13. Suarez GA, Opfer-Gehrking TL, Offord KP et al. The Autonomic Symptom Profile: a new instrument to assess autonomic symptoms. Neurology 1999; 52(3): 523– 528.
14. Zilliox L, Peltier AC, Wren PA et al. Assessing autonomic dysfunction in early diabetic neuropathy: the survey of autonomic symptoms. Neurology 2011; 76(12): 1099– 1105. doi: 10.1212/ WNL.0b013b3182120147.
15. Freeman R, Chapleau MW. Testing the autonomic nervous system. Handb Clin Neurol 2013; 115 : 115– 136. doi: 10.1016/ B978-0-444-52902-2.00007-2.
16. Goldstein DS, Low PA. Clinical evaluation of the autonomic nervous system. CONTINUUM: Lifelong Learning in Neurology 2007; 13(6): 33– 49. doi: 10.1212/ 01.CON.0000299965.28266.ec.
17. Low PA, Tomalia VA, Park KJ. Autonomic function tests: some clinical applications. J Clin Neurol 2013; 9(1): 1– 8. doi: 10.3988/ jcn.2013.9.1.1.
18. Mathias CJ, Iodice V, Low D. Autonomic dysfunction: recognition, diagnosis, investigation, management, and autonomic rehabilitation. Handb Clin Neurol 2013; 110 : 239– 253. doi: 10.1016/ B978-0-444-52901-5.00020-4.
19. Sandroni P. Clinical evaluation of autonomic disor-ders. In: Robertson D, Biaggioni I, Burnstock G et al (eds).Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 377– 382. doi: 10.1016/ B978-0-12-386525-0.00078-0.
20. Singer W, Mauermann M, Benarroch EE. Evaluation of autonomic disorders. In: Benarroch EE, ed. Autonomic neurology. New York: Oxford University Press 2014 : 49– 70. doi: 10.1093/ med/ 9780199920198.003.0005.
21. Zygmunt A, Stanczyk J. Methods of evaluation of autonomic nervous system function. Arch Med Sci 2010; 6(1): 11– 18. doi: 10.5114/ aoms.2010.13500.
22. Opavský J. Autonomní nervový systém a diabetická autonomní neuropatie. Klinické aspekty a diagnostika. Praha: Galén 2002 : 304.
23. Ewing DJ, Martyn CN, Young RJ et al. The value of cardiovascular autonomic function tests: 10 years experience in dabetes. Diabetes Care 1985; 8(5): 491– 498.
24. Javorka K (ed). Variabilita frekvencie srdca. Martin: Osveta 2008 : 204.
25. Task force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. Circulation 1996; 93(5): 1043– 1065.
26. Freeman RL. Noninvasive evaluation of heart rate: time and frequency domains. In: Low PA, Benarroch EE (eds). Clinical autonomic disorders. 3rd ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 185– 197.
27. Opavský J, Salinger J. Vyšetřovací metody funkcí autonomní nervové soustavy – přehled pro potřeby klinické praxe. Noninvas Cardiol 1995; 4(3): 139– 153.
28. Javorka M. Hodnotenie variability frekvencie srdca metódami nelineárnej dynamiky. In: Javorka K (ed). Variabilita frekvence srdca. Martin: Osveta 2008 : 54– 57.
29. Ernst G. Heart Rate Variability. London: Springer 2014. doi: 10.1007/ 978-1-4471-4309-3_5.
30. Benarroch EE. The arterial baroreflex: functional organization and involvement in neurologic disease. Neurology 2008; 71(21): 1733– 1738. doi: 10.1212/ 01.wnl0000335246.93495.92.
31. Huang CC, Sandroni P, Sletten DM et al. Effect of age on adrenergic and vagal baroreflex sensitivity in normal subjects. Muscle Nerve 2007; 36(5): 637– 642. doi: 10.1002/ mus.20853.
32. Wehrwein EA, Joyner MJ. Regulation of blood pressure by the arterial baroreflex and autonomic nervous system. Handb Clin Neurol 2013; 117 : 89– 102. doi: 10.1016/ B978-0-444-53491-0.00008-0.
33. Goldstein DS. Clinical sympathetic imaging. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 399– 403. doi: 10.1016/ B978-0-12-386525-0.00082-2.
34. Goldstein DS. Sympathetic neuroimaging. Handb Clin Neurol 2013; 117 : 365– 370. doi: 10.1016/ B978-0-444-53491-0.00029-8.
35. Schürmann M, Gradl G, Fürst H. A standardized bedside test for assessment of peripheral sympathetic nervous function using laser Doppler flowmetry. Microvasc Res 1996; 52(2): 157– 170.
36. Hilz MJ, Hecht MJ, Berghoff M et al. Abnormal vasoreaction to arousal stimuli: an early sign of diabetic sympathetic neuropathy demonstrated by laser Doppler flowmetry. J Clin Neurophysiol 2000; 17(4): 419– 425.
37. Benarroch EE. Gastrointestinal dysmotility. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 158– 169. doi: 10.1093/ med/ 9780199920198.003.0012.
38. Kadaňka Z Jr. Elektrofyziologické vyšetření pánevního dna. Cesk Slov Neurol N 2013; 76/ 109(2): 155– 161.
39. Benarroch EE, Mauermann ML. Neurogenic bladder and sexual dysfunction. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 144– 157. doi: 10.1093/ med/ 9780199920198.003.0011.
40. Benarroch EE. Disorders of sweating. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 126– 143. doi: 10.1093/ med/ 9780199920198.003.0010.
41. Schondorf R. Assessment of sudomotor function. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 409– 411. doi: 10.1016/ B978-0-12-386525-0.00084-6.
42. Vlčková E, Šrotová I, Bednařík J. Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken. Cesk Slov Neurol N 2016; 79/ 112(1): 52– 60.
43. Casellini CM, Parson HK, Richardon MS et al. Sudoscan, a noninvasive tool for detecting diabetic small fibre neuropathy and autonomic dysfunction. Diabetes Technol Ther 2013; 15(11): 948– 953. doi 10.1089/ dia.2013.0129.
44. Chahal S, Vohra K, Syngle A. Association of sudomotor function with peripheral artery disease in type 2 diabetes. Neurol Sci 2017; 38(1): 151– 156. doi.org/ 10.1007/ s10072-016-2742-3.
45. Bremner FD, Smith SE. Pupil abnormalities in selected autonomic neuropathies. J Neuroophtalmol 2006; 26(3): 209– 219.
46. Joos KM, Melson MR. Control of the pupil. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 239– 242. doi: 10.1016/ B978-0-12-386525-0.00049-4.
47. Matoušková O, Slanař O, Chytil L et al. Pupilometrie jako bioindikátor účinku léčiv. Čas Lék Čes 2010; 149(2): 66– 68.
48. Muppidi S, Adams-Huet B, Tajzoy E et al. Dynamic pupillometry as an autonomic testing tool. Clin Auton Res 2013; 23(6): 297– 303. doi: 10.1007/ s10286-013-0209-7.
49. Macefield VG. Sympathetic microeurography. Handb Clin Neurol 2013; 117 : 353– 364. doi: 10.1016/ B978-0-444-53491-0.00028-6.
50. Vallbo ÅB, Hagbarth KE, Wallin BG. Microneurography: how the technique developed and its role in the investigation of the sympathetic nervous system. J Appl Physiol 2004; 96(4): 1262– 1269. doi: 10.1152/ japplphysiol.00470.2003.
51. Wallin BG. Sympathetic microneurography. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 389– 392. doi: 10.1016/ B978-0-12-386525-0.00080-9.
52. Gibbons CH, Freeman R. Cutaneous autonomic inervation: assessment by skin biopsy. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 413– 417. doi: 10.1016/ B978-0-12-386525-0.00085-8.
53. Buršová Š, Vlčková E, Hnojčíková M et al. Vyšetření hustoty intraepidermálních nervových vláken z kožní biopsie – normativní data. Cesk Slov Neurol N 2012; 75/ 108(4): 455– 459.
54. Wang N, Gibbons CH. Skin biopsies in the assessment of the autonomic nervous system. Handb Clin Neurol 2013; 117 : 371– 378. doi: 10.1016/ B978-0-444-53491-0-0.00030-4.
55. Izzo JL Jr, Fernandez SF. Biochemical assessment of sympatoadrenal activity. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 2nd ed. San Diego: Elsevier 2004 : 234– 238.
56. Low PA, Sletten DM. Laboratory evaluation of autonomic failure. In: Low PA, Benarroch EE (eds). Clinical autonomic disorders. 3rd ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 130– 163.
57. Eisenhofer G, Kopin IJ, Goldstein DS. Catecholamine metabolism: a contemporary view with implications for physiology and medicine. Pharmacol Rev 2004; 56(3): 331– 349. doi: 10.1124/ pr.56.3.1.
58. Goldstein DS, Eisenhofer G, Kopin IJ. Sources and significance of plasma levels of catechols and their metabolites in humans. J Pharmacol Exp Ther 2003; 305(3): 800– 801.
59. Harati Y, Izadyar S. Hereditary autonomic neuropathies. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 495– 498. doi: 10.1016/ B978-0-12-386525-0.00102-5.
60. Kaufmann H, Norcliffe-Kaufmann L, Axelrod FB. Familial dysautonomia (Riley-Day syndrome). In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 499– 502. doi: 10.1016/ B978-0-12-386525-0.00103-7.
61. Mauermann ML, Singer W. Neuropathic pain disorders with autonomic component. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 217– 226. doi: 10.1093/ med/ 9780199920198.003.0016.
62. Verrotti A, Prezioso G, Scattoni R et al. Autonomic neuropathy in diabetes mellitus. Front Endocrinol (Lausanne) 2014; 5 : 205. doi: 10.3389/ fendo.2014.00205.
63. Vinik AI, Erbas T. Diabetic autonomic neuropathy. Handb Clin Neurol 2013; 117 : 279– 294. doi: 10.1016/ B978-0-444-53491-0.00022-5.
64. Lacigová S, Tomešová J, Gruberová J. Diabetická autonomní neuropatie. Neurol Praxi 2012; 13 (Suppl E): 16– 19.
65. Peltier AC, Davis SN. Diabetic autonomic dysfunction. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 477– 481. doi: 10.1016/ B978-0-12-386525-0.00098-6.
66. Vinik AI, Erbas T, Casellini CM. Diabetic cardiac autonomic neuropathy, inflammation and cardiovascular disease. J Diabetes Investig 2013; 4(1): 4– 18. doi: 10.1111/ jdi.12042.
67. Hausberg M, Kosch M, Harmelink P et al. Sympathetic nerve activity in end-stage renal disease. Circulation 2002; 106(15): 1974– 1979.
68. Robinson TG, Carr SJ. Cardiovascular autonomic dysfunction in uremia. Kidney Int 2002; 62(6): 1921– 1932. doi: 10.1046/ j.1523– 1755.2002.00659.x.
69. Salman IM. Cardiovascular autonomic dysfunction in chronic kidney diseae: a comprehensive review. Curr Hypertens Rep 2015; 17(8): 59. doi:10.1007/ s11906-015-0571-z.
70. Di Stefano C, Milazzo V, Milan A et al. The role of autonomic dysfunction in cirrhotic patients before and after liver transplantation. Review of the literature. Liver Int 2016; 36(8): 1081– 1089. doi: 10.1111/ liv.13126.
71. Frith J, Newton JL. Autonomic dysfunction in chronic liver disease. Hepat Med 2011; 3 : 81– 87. doi: 10.2147/ HMER.S16312.
72. Harati Y, Phan CL. Amyloidotic autonomic silure. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 483– 487. doi: 10.1016/ B978-0-12-386525-0.00099-8.
73. Mauermann ML, Tracy JA, Singer W. Autonomic neuropathies. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 205– 216. doi: 10.1093/ med/ 9780199920198.003.0015.
74. Harati Y, Nawasiripong O. Hereditary autonomic neuropathies. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 2nd ed. San Diego: Elsevier 2004 : 316– 319.
75. Low PA, McLeod JG. Guillain-Barré syndrome. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 493– 494. doi: 10.1016/ B978-0-12-386525-0.00101-3.
76. Vernino S, Low PA. Autoimmune autonomic gangliopathy. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 489– 492. doi: 10.1016/ B978-0-12-386525-0.00100-1.
77. Muppidi S, Vernino S. Autoimmune autonomic failure. Handb Clin Neurol 2013; 117 : 321– 327. doi: 10.1016/ B978-0-444-53491-0.00025-0.
78. McKeon A, Bennaroch EE. Autoimmune autonomic disorders. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 227– 239. doi: 10.1093/ med/ 9780199920198.003.0017.
79. Carod-Artal FJ. Infectious diseases causing autonomic dysfunction. Clin Auton Res 2018; 28(1): 67– 81. doi: 10.1007/ s10286-017-0452-4.
80. Robinson-Papp J, Sharma S, Simpson DM et al. Autonomic dysfunction is common in HIV and associated with distal symmetric polyneuropathy. J Neurovirol 2013; 19(2): 172– 180. doi: 10.1007/ s13365-013-0160-3.
81. McKeon A, Lennon VA, Lachance DH et al. Ganglionic acetylcholine receptor autoantibody: oncological, neurological, and serological accompaniments. Arch Neurol 2009; 66(6): 735– 741. doi: 10.1001/ archneurol.2009.78.
82. Sharp L, Vernino S. Paraneoplastic neuromuscular disorders. Muscle Nerve 2012; 46(6): 841– 850. doi: 10.1002/ mus.23502.
83. Garland EM, Hooper WB, Robertson D. Pure autonomic failure. Handb Clin Neurol 2013; 117 : 243– 257. doi: 10.1016/ B978-0-444-53491-0.00020-1.
84. Kaufmann H, Schatz IJ. Pure autonomic failure. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 467– 469. doi: 10.1016/ B978-0-12-386525-0.00096-2.
85. Sambati L, Buonara-Calandra G, Doria A et al. Diagnosis and management of autonomic failure in neurodegenerative disorders. Eur Neurol 2015; 73(1– 2): 126– 133. doi: 10.1159/ 000368828.
86. Luther JM. Drug-induced autonomic dysfunction. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 511– 514. doi: 10.1016/ B978-0-12-386525-0.00105-0.
87. Fang JY, Davis TL. Parkinson’s disease. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 459– 461. doi: 10.1016/ B978-0-12-386525-0.00094-9.
88. Kaufmann H, Goldstein DS. Autonomic dysfunction in Parkinson disease. Handb Clin Neurol 2013; 117 : 259– 278. doi: 10.1016/ B978-0-444-53491-0.00021-3.
89. Pfeiffer RF. Autonomic dysfunction in Parkinson’s disease. Expert Rev Neurother 2012; 12(6): 697– 706. doi: 10.1586/ ern.12.17.
90. Uhlíř P, Opavský J, Zaatar A. The effect of rehabilitation on heart rate variability in patients with Parkinson’s disease. Acta Univ Palacki, Gymn 2012; 42(3): 49– 54.
91. Kaiserová M. Autonomní dysfunkce u Parkinsonovy nemoci. Postgradual Med 2015; 17(1): 34– 40.
92. Kaufmann H, Goldstein DS. Autonomic failure in neurodegenerative disorders. CONTINUUM: Lifelong Learning in Neurology 2007; 13(6): 111– 142. doi: 10.1212/ 01.CON.0000299968.51137.e4.
93. Robertson D, Gilman S. Multiple system atrophy. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 453– 457. doi: 10.1016/ B978-0-12-386525-0.00093-7.
94. Wenning GK, Krismer F. Multiple system atrophy. Handb Clin Neurol 2013; 117 : 229– 241. doi: 10.1016/ B978-0-444-53491-0.00019-5.
95. Stemberger S, Stampfer M, Wenning GK. Dementia with Lewy bodies. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 463– 466. doi: 10.1016/ B978-0-12-386525-0.00095-0.
96. Benarroch EE, Stotz-Potter EH. Dysautonomia in fatal familial insomnia as an indicator of the potential role of the thalamus in autonomic control. Brain Pathol 1998; 8(3): 527– 530.
97. Mackay J, Downs J, Wong K et al. Autonomic breathing abnormalities in Rett syndrome: caregiver perspectives in an international diabase study. J Neurodev Disord 2017; 9 : 15. doi: 10.1186/ s11689-017-9196-7.
98. Záhoráková D, Martásek P. Rettův syndrom. Cesk Slov Neurol N 2009; 72/ 105(6): 525– 533.
99. Kumar A, Jaryal A, Gulati S et al. Cardiovascular autonomic dysfunction in children and adolescents with Rett syndrome. Pediatr Neurol 2017; 70 : 61– 66. doi: 10.1016/ j.pediatr.neurol.2017.01.010.
100. Mathias CJ, Low PA. Autonomic disturbances in spinal cord injuries. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 505– 509. doi: 10.1016/ B978-0-12-386525-0.00104-9.
101. Kříž J, Rejchrt M. Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy. Cesk Slov Neurol N 2014; 77/ 110(2): 168– 173.
102. Krassioukov AV, Karlsson AK, Wecht JM et al. Asses-sment of autonomic system dysfunction following spinal cord injury: rationale for additions to International Standards for Neurological Assessment. J Rehabil Res Dev 2007; 44(1): 103– 112. doi: 10.1682/ JRRD.2005.10.0159.
103. Ondrušová K, Nováková M. Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy. Cesk Slov Neurol N 2014; 77/ 110(2): 174– 178.
104. Uhlíř P, Opavský J, Zaatar A et al. Spectral analysis of heart rate variability in patients with spinal cord Indry. Acta Univ Palacki Olomuc, Gymn 2010; 40(2): 55– 62.
105. Britton JW, Moseley B, Benarroch EE. Focal disorders of the cerebral hemispheres and brainstem. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 240– 251. doi: 10.1093/ med/ 9780199920198.003.0018.
106. Al-Qudah ZA, Yacoub HA, Souayah N. Disorder of the autonomic nervous system after hemispheric cerebrovascular disorders: an update. J Vasc Interv Neurol 2015; 8(4): 43– 52.
107. Chen CF, Lin HF, Lin RT et al. Relationship between ischemic stroke location and autonomic cardiac function. J Clin Neurosci 2013; 20(3): 406– 409. doi: 10.1016/ j.jocn.2012.02.047.
108. Oppenheimer S. Cerebrogenic cardiac arrhythmias: cortical localization and clinical significance. Clin Auton Res 2006; 16(1): 6– 11. doi: 10.1007/ s10286-006-0276-0.
109. Meyer S, Strittmater M, Fischer C et al. Lateralization in autonomic dysfunction in ischemic stroke involving the insular cortex. Neuroreport 2004; 15(2): 357– 361.
110. Wijnen VJ, Heutink M, van Boxtel GJ et al. Autonomic reactivity to sensory stimulation is related to consciousness level after severe traumatic brain injury. Clin Neurophysiol 2006; 117(8): 1794– 1807. doi: 10.1016/ j.clinph.2006.03.006.
111. Amichai T, Katz-Leurer M. Heart rate variability in children with cerebral palsy: review of the literature and meta-analysis. Neuro Rehabilitation 2014; 35(1): 113– 122. doi: 10.3233/ NRE-141097.
112. Dütsch M, Hilz MJ. Epilepsy and autonomic regulation. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 549– 552. doi: 10.1016/ B978-0-12-386525-0.00114-1.
113. Adamec I, Habek M. Autonomic dysfunction in multiple sclerosis. Clin Neurol Neurosurg 2013; 115 (Suppl 1): S73– S78. doi: 10.1016/ j.clineuro.2013.09.026.
114. Racosta JM, Kimpinski K, Morrow SA et al. Autonomic dysfunction in multiple sclerosis. Auton Neurosci 2015; 193 : 1– 6. doi: 10.1016/ autneu.2015.06.001.
115. Šrotová I, Vlčková E, Bednařík J. Autonomní dysfunkce a její diagnostika u roztroušené sklerózy. Cesk Slov Neurol N 2016; 79/ 112(2): 188– 198.
116. Riedlbauchová L, Nedělka T, Schlenker J. Symptomatic arrhythmias due to syringomyelia-induced severe autonomic dysfunction. Clin Res Cardiol 2014; 103(10): 839– 845. doi: 10.1007/ s00392-014-0725-z.
117. Miglis MG. Autonomic dysfunction in primary sleep disorders. Sleep Med 2016; 19 : 40– 49. doi: 10.1016/ j.sleep.2015.10.001.
118. Kato M. Impaired autonomic function in patients with obstructive sleep apnea. Hypertens Res 2007; 30(8): 659– 660. doi: 10.1291/ hypres.30.659.
119. Martín-Gallego A, Andrade-Andrade I, Dawid-Milner MS et al. Autonomic dysfunction elicited by a medulla oblongata injury after fourth ventricle tumor surgery in a pediatric patient. Auton Neurosci 2016; 194 : 52– 57. doi: 10.1016/ j.autneu.2015.12.002.
120. Hong JM, Kim TJ, Shin DH et al. Cardiovascular autonomic function in lateral medullary infarction. Neurol Sci 2013; 34(11): 1963– 1969. doi:10.1007/ s10072-013-1420-y.
121. Altavilla R, Landi D, Altamura C et al. Dorsolateral medullary ischemic infarction causing autonomic dysfunction and headache: a case report. J Headache Pain 2012; 13(4): 327– 330. doi: 10.1007/ s10194-012-0427-8.
122. Freeman R, Wieling W, Axelrod FB et al. Consensus statement on the definition of orthostatic hypotension, neurally mediated syncope and the postural tachycardia syndrome. Clin Auton Res 2011; 21(2): 69– 72. doi: 10.1007/ s102/ 86-011-0119-5.
123. Britton JW, Moseley B, Benarroch EE. Syncope and other causes of transient loss of consciousness. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 110– 125. doi: 10.1093/ med/ 9780199920198.003.0009.
124. Šeblová J, Škulec R. Diferenciální diagnostika kolapsových stavů a přechodných poruch vědomí. Med Praxi 2011; 8(6): 265– 267.
125. Kautzner J. Doporučení pro diagnostiku a léčbu synkopy – Česká kardiologická společnost. Cor Vasa 2007; 49 (2, Suppl K): 43– 53.
126. Stewart J. Symptoms and signs of postural tachycardia syndrome (POTS). In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 525– 528. doi: 10.1016/ B978-0-12-386525-0.00108-6.
127. Singer W, Benarroch EE. Postural tachycardia syndrome. In: Benarroch EE (ed). Autonomic neurology. New York: Oxford University Press 2014 : 89– 98. doi: 10.1093/ med/ 9780199920198.003.0007.
128. Vykoupil K. Současný pohled na syndrom posturální tachykardie. Cor Vasa 2016; 58(4): 474– 478.
129. Opavský J. Clinical evaluation of autonomic (interoreflex) heart rate regulation. Application to diagnosis of autonomic neuropathy. Acta Univ Palacki Fac Med 1988 : 159– 278.
130. Schmidt HB, Werdan K, Müller-Werdan U. Autonomic dysfunction in the ICU patient. Curr Opin Crit Care 2001; 7(5): 314– 322.
131. Schmidt H, Hoyer D, Hennen R et al. Autonomic dysfunction predicts both 1 - and 2 - month mortality in middle-aged patients with multiple organ dysfunction syndrome. Crit Care Med 2008; 36(3): 967– 970. doi: 10.1097/ CCM.0B013E381653263.
132. Kanagalingam S, Miller NR. Horner syndrome: clinical perspectives. Eye Brain 2015; 7 : 35– 46. doi: 10.2147/ EB.S63633.
133. Guaraldi P, Mathias CJ. Progression of cardiovascular autonomic dysfunction in Holmes-Adie syndrome. J Neurol Neurosurg Psychiatry 2011; 82(9): 1046– 1049. doi: 10.1136/ jnnp.2009.195917.
134. Jänig W. Complex regional pain syndrome. In: Robertson D, Biaggioni I, Burnstock G et al (eds). Primer on the autonomic nervous system. 3rd ed. San Diego: Academic Press 2012 : 583– 587. doi: 10.1016/ B978-0-12-386525-0.00121-9.
135. Opavský J. Bolest v ambulantní praxi. Od diagnózy k léčbě častých bolestivých stavů. Praha: Maxdorf 2011 : 351– 356.
136. McCoy FJ, Goodman RC. The crocodile tear syndrome. Plast Reconstr Surg 1979; 63(1): 58– 62.
137. Adamec I, Habek M. Crocodile tears syndrome. Clin Auton Res 2016; 26(2): 167. doi: 10.1007/ s10286-015-0337-3.
138. Lance JW, Drummond PD, Gandevia SC et al. Harlequin syndrome: the sudden onset of unilateral flushing and sweating. J Neurol Neurosurg Psychiatry 1988; 51(5): 635– 642.
139. Tascilar N, Tekin NS, Erdem Z et al. Unnoticed dysautonomic syndrome of the face: Harlequin syndrome. Auton Neurosci 2007; 137(1– 2): 1– 9.
140. Zabalza Estévez RJ, Unanue López FU. Harlequin syndrome, a rare neurological disease. Neurologia 2015; 30(3): 185– 187. doi: 10.1016/ j.nrl.2013.04.007.
141. Lacigová S, Rušavý Z, Jirkovská A et al. Doporučený postup diagnostiky a léčby diabetické neuropatie (2016). DMEV 2016; 19(2): 57– 63.
142. Opavský J. Autonomní nervový systém a diabetická autonomní neuropatie. Klinické aspekty a diagnostika. Praha: Galén 2002 : 49– 58.
143. Lahrmann H, Rocha I, Struhal W et al. Diagnosing autonomic nervous system disorders – existing guidelines and future perspectives. Eur Neurol Rev 2011; 6(1): 52– 56. doi: 10.17925/ ENR.2011.06.01.52.
144. Gibbons CH, Cheshire WP Jr, Fife TD. American Academy of Neurology model coverage policy: autonomic nervous system testing. 2014 : 1– 10. Available from URL: https:/ / www.aan.com/ siteassets/ home-page/ tools-and-resources/ practicing-neurologist-administrators/ billing-and-coding/ model-coverage-policies/ 14autonomicmodel_tr.pdf.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2018 Číslo 6
-
Všechny články tohoto čísla
- Diagnostika, symptomatika a nálezy u onemocnění a poruch autonomního nervového systému v neurologii
- Pacient s rozsáhlými časnými změnami (ASPECTS < 5) – rekanalizace - ANO
- Pacient s rozsáhlými časnými změnami (ASPECTS < 5) – rekanalizace - NE
-
Pacient s rozsiahlymi skorými zmenami (ASPECTS < 5) – rekanalizácia
Komentár ku kontroverziám - Těhotenství a roztroušená skleróza z pohledu neurologa
- Kvalita života osob pečujících o pacienty s progresivním neurologickým onemocněním
- Nově vzniklý refrakterní status epilepticus a syndromy z blízkého spektra (NORSE/ FIRES)
- Efektivita jednostranné kochleární implantace u dospělých pacientů s těžkou poruchou sluchu
- Klinické výsledky krčnej diskektómie a fúzie ukotvenou klietkou – prospektívna štúdia so sledovaním 24 mesiacov
- Srovnání miniinvazivní perkutánní a klasické otevřené stabilizační operace u zlomenin Th-L páteře – retrospektivní analýza
- Rekonstrukce durálních defektů xenogenním implantátem
- Fingolimod zmírňuje harmalinem navozenou poruchu paměti spojenou s pasivním vyhýbáním a motorické poruchy u potkaního modelu esenciálního tremoru - komentář k článku
- Vyhodnocení systolických a diastolických srdečních funkcí a variability srdeční frekvence u pacientů s juvenilní myoklonickou epilepsií
- Rekonstrukce přední jámy lební volným svalovým lalokem po iatrogenním poškození
- Bulharská rodina s epileptickými záchvaty jako prvním projevem familiárních cerebrálních kavernózních malformací
- Meningokoková meningitida s Chiariho malformací (typ I)
- Solitární cerebelární metastáza uterinního cervikálního karcinomu
- Abstrakta přednášek, které odezněly na XI. neuromuskulárním kongresu Brno, 10.–11. května 2018
- Analýza dat v neurologii
- Komentář k článku autorů Voháňka et al Anestezie a nervosvalová onemocnění Cesk Slov Neurol N 2018; 81/114(4): 501–514.
- Recenze knih
- Prof. MUDr. Ivan Rektor, CSc., FCMA, FANA, FEAN slaví významné životní jubileum
- Prof. MU Dr. Martin Bareš, Ph.D., padesátiletý
- Výroční kongres České neurochirurgické společnosti
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Diagnostika, symptomatika a nálezy u onemocnění a poruch autonomního nervového systému v neurologii
- Nově vzniklý refrakterní status epilepticus a syndromy z blízkého spektra (NORSE/ FIRES)
- Klinické výsledky krčnej diskektómie a fúzie ukotvenou klietkou – prospektívna štúdia so sledovaním 24 mesiacov
- Těhotenství a roztroušená skleróza z pohledu neurologa

